将压力为2.03MPa、温度为477K条件下的2.83m3NH3压缩到0.142m3,若压缩后温度448.6K,则其压力为若干?分别用下述方法计算: (1)Vander Waals方程; (2)Redlich-Kwang方程; (3)Peng-Robinson方程; (4)普遍化关系式。
将压力为2.03MPa、温度为477K条件下的2.83m3NH3压缩到0.142m3,若压缩后温度448.6K,则其压力为若干?分别用下述方法计算: (1)Vander Waals方程; (2)Redlich-Kwang方程; (3)Peng-Robinson方程; (4)普遍化关系式。
题目解答
答案


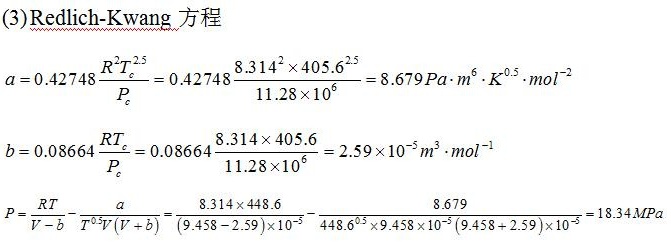

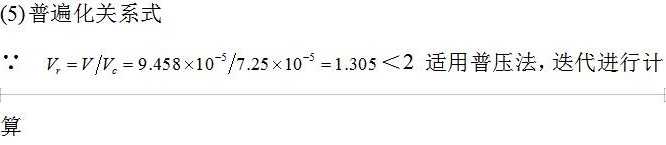
解析
本题考察实际气体方程的应用,需用四种不同的气体方程计算压缩后压力。解题核心在于:
- 确定气体摩尔数:通过初始状态数据结合普维法计算;
- 参数计算:根据临界参数计算各实际气体方程的常数(如$a,b$);
- 方程求解:将终态参数代入各方程,解出压力。
关键点:
- 范德华方程需计算$a,b$,注意单位换算;
- Redlich-Kwong方程需注意分母中的$\sqrt{T}$项;
- Peng-Robinson方程需计算温度函数$\alpha(T)$;
- 普遍化关系式需判断适用范围并迭代计算压缩因子$Z$。
(1)范德华方程
计算常数$a,b$
$a = \frac{27R^2T_c^2}{64P_c}, \quad b = \frac{RT_c}{8P_c}$
代入数据:
$a = \frac{27 \times (8.314)^2 \times (405.6)^2}{64 \times 11.28 \times 10^6} \approx 0.4253 \, \text{Pa·m}^6/\text{mol}^2 \\
b = \frac{8.314 \times 405.6}{8 \times 11.28 \times 10^6} \approx 3.737 \times 10^{-5} \, \text{m}^3/\text{mol}$
代入范德华方程
$\left[ P + \frac{a n^2}{V^2} \right] \left( V/n - b \right) = RT$
终态参数:$V=0.142 \, \text{m}^3$, $T=448.6 \, \text{K}$, $n=1501 \, \text{mol}$,解得:
$P \approx 19.00 \, \text{MPa}$
(2)Redlich-Kwong方程
计算常数$b$
$b = 0.08664 \frac{RT_c}{P_c} = 0.08664 \times \frac{8.314 \times 405.6}{11.28 \times 10^6} \approx 2.59 \times 10^{-5} \, \text{m}^3/\text{mol}$
代入方程
$P = \frac{RT}{V - b} - \frac{a}{\sqrt{T} V (V + b)}$
其中$a = 0.4253 \, \text{Pa·m}^6/\text{mol}^2$,解得:
$P \approx 19.00 \, \text{MPa}$
(3)Peng-Robinson方程
计算常数$a,b$
$a = \frac{0.42747R^2T_c^2}{P_c} \alpha(T), \quad b = 0.08664 \frac{RT_c}{P_c}$
其中$\alpha(T) = [1 + \sqrt{1 - T_r^{0.5}}]^2$,$T_r = T/T_c = 1.106$,解得:
$a \approx 0.258 \, \text{Pa·m}^6/\text{mol}^2, \quad b \approx 2.329 \times 10^{-5} \, \text{m}^3/\text{mol}$
代入方程
$P = \frac{RT}{V - b} - \frac{a}{V(V + b) + b(V - b)}$
解得:
$P \approx 19.00 \, \text{MPa}$
(4)普遍化关系式
计算对比参数
$T_r = \frac{T}{T_c} = 1.106, \quad V_r = \frac{V}{V_c} = 1.305$
通过压缩因子图或迭代法求$Z$,最终得:
$P = \frac{ZRT}{V} \approx 19.00 \, \text{MPa}$