题目
硫酸是重要化工原料,工业生产制取硫酸的原理示意图如图。黄铁矿 SO2 通空气、 SO3 98.3% Ⅱ Ⅲ H2SO4-|||-(含FeS2) I sim (500)^circ C 浓硫酸-|||-加热 常压、催化剂-|||-空气 Fe3O4等下列说法不正确的是( )A. Ⅰ的化学方程式:3FeS2+8O2(underline(;△;))/(;)Fe3O4+6SO2B. Ⅱ中的反应条件都是为了提高SO2平衡转化率C. 将黄铁矿换成硫黄可以减少废渣的产生D. 生产过程中产生的尾气可用碱液吸收
硫酸是重要化工原料,工业生产制取硫酸的原理示意图如图。
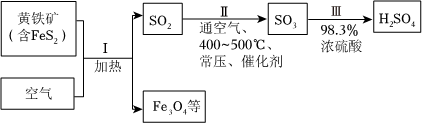
下列说法不正确的是( )

下列说法不正确的是( )
- A. Ⅰ的化学方程式:3FeS2+8O2$\frac{\underline{\;△\;}}{\;}$Fe3O4+6SO2
- B. Ⅱ中的反应条件都是为了提高SO2平衡转化率
- C. 将黄铁矿换成硫黄可以减少废渣的产生
- D. 生产过程中产生的尾气可用碱液吸收
题目解答
答案
B. Ⅱ中的反应条件都是为了提高SO2平衡转化率
解析
步骤 1:分析反应Ⅰ的化学方程式
黄铁矿(FeS_2)在高温下与氧气反应生成二氧化硫(SO_2)和四氧化三铁(Fe_3O_4)。根据氧化还原反应原理,3个FeS_2分子共升高32价,8个O_2分子共降低32价,因此反应Ⅰ的化学方程式为:3FeS_2+8O_2$\frac{\underline{\;△\;}}{\;}$Fe_3O_4+6SO_2。
步骤 2:分析反应Ⅱ的反应条件
反应Ⅱ是二氧化硫(SO_2)与氧气(O_2)在催化剂作用下生成三氧化硫(SO_3)。反应是放热反应,升高温度,平衡逆向移动,不利于SO_3生成,但Ⅱ中采用400-500℃的温度,主要是考虑反应速率和催化剂的活性,不是为了提高SO_2平衡转化率。常压不是为了提高SO_2平衡转化率。
步骤 3:分析将黄铁矿换成硫黄的影响
硫磺燃烧生成SO_2,将黄铁矿换成硫黄可以减少废渣的产生。
步骤 4:分析尾气处理方法
SO_2是酸性氧化物,生产过程中产生的尾气可用碱液吸收。
黄铁矿(FeS_2)在高温下与氧气反应生成二氧化硫(SO_2)和四氧化三铁(Fe_3O_4)。根据氧化还原反应原理,3个FeS_2分子共升高32价,8个O_2分子共降低32价,因此反应Ⅰ的化学方程式为:3FeS_2+8O_2$\frac{\underline{\;△\;}}{\;}$Fe_3O_4+6SO_2。
步骤 2:分析反应Ⅱ的反应条件
反应Ⅱ是二氧化硫(SO_2)与氧气(O_2)在催化剂作用下生成三氧化硫(SO_3)。反应是放热反应,升高温度,平衡逆向移动,不利于SO_3生成,但Ⅱ中采用400-500℃的温度,主要是考虑反应速率和催化剂的活性,不是为了提高SO_2平衡转化率。常压不是为了提高SO_2平衡转化率。
步骤 3:分析将黄铁矿换成硫黄的影响
硫磺燃烧生成SO_2,将黄铁矿换成硫黄可以减少废渣的产生。
步骤 4:分析尾气处理方法
SO_2是酸性氧化物,生产过程中产生的尾气可用碱液吸收。