题目
(2010上海)(O)_(3)广泛存在于自然界,是一种重要的化工原料。大理石主要成分为(O)_(3),另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备(O)_(3)气体。下列装置可用于(O)_(3)气体的提纯和干燥。(O)_(3)完成下列填空:1)用浓盐酸配制1:1(体积比)的稀盐酸(约6(O)_(3)),应选用的仪器是_____。A. 烧杯 B. 玻璃棒 C. 量筒d.容量瓶 D. 是____溶液,(O)_(3)溶液可以吸收_____。 E. _____。用这个实验得到的气体测定(O)_(3)的分子量,如果B物质失效,测定结果____(填“偏高”、“偏低”或“不受影响”)。 F. 4)一次性饭盒中石蜡(高级烷烃)和(O)_(3)在食物中的溶出量是评价饭盒质量的指标之 一,测定溶出量的主要实验步骤设计如下: G. 剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重 ______。 氯化钠溶液 稀醋酸 稀硫酸d 正已烷 _____后溶出_______。 _______,说明样品已经恒重。 26(2010).(本题共12分) 2)(O)_(3)溶液或酸性(O)_(3)溶液: 吸收HCl气体或吸收酸性气体 3)无水(O)_(3)偏低 4)b d OOlg (05广东)11、下列各组物质仅用蒸馏水不能鉴别出的是 苯、酒精、硝基苯 食盐、烧碱、硝酸铵 蔗糖、硫酸铜粉末、碳酸钙粉末 D、氧化铜、二氧化猛、活性炭 。 A项:苯密度比水小,和水混合后上层是无色透明油状液体,下层是水, 酒精与水任意比例互溶,不分层, 硝基苯密度比水大,和水混合后,上层是水,下层是无色透明油状液体。 B根据3种物质在水中溶解时是吸热、放热还是温度不变可以判断。 C根据3种物质在水中溶解时所致溶液颜色是蓝色、透明、悬浊液(不溶)可以判断出。 唯独D中3种物质无法用蒸馏水分辨。 (05广东)9、下列实验操作与安全事故处理错误的是c 使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 用试管夹从试管底由下往上夹住试管口约(O)_(3)处,手持试管夹长柄末端,进行加热 制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中 铜与浓硝酸反应制NO2 铜与稀硝酸反应制NO 乙醇与浓硫酸反应制乙烯 氯化钠与浓硫酸反应制HCl 中NO2会溶于水,C中需温度计,HCl溶于水 浓硝酸保存在无色玻璃试剂瓶中 少量的钠保存在煤油中 氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中 新制的氯水通常保存在棕色玻璃试剂瓶中 稀硫酸、氯化钡溶液 硫酸亚铁溶液、氢氧化钠溶液 氯化钠溶液、硝酸银溶液 D 氯化铝溶液、氢氧化钠溶液 配制50 g质量分数为5% NaCl溶液:将45 mL NaCl的烧杯中,搅拌溶解 制备乙酸乙酯:用如右图所示的实验装置(解析:需要温度计) 鉴定SO(O)_(3):向溶液中加入盐酸酸化的氯化钡溶液 鉴别环已烯和苯:将溴的四氯化碳溶液分别滴加到少量环已烯和苯中 除去CO中少量O2:通过灼热的Cu网后收集气体(解析:CO会和O2与Cu生成的CuO反应) 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤(解析:引入了单质溴杂质) 除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置 ) 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 璃导管蘸水后,边旋转边向橡皮管中插入 热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量 璃棒蘸取溶液滴到放在表面皿上的pH试纸上 ) 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯ 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯ 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ D ) (O)_(3) H2O)2,要确定(H2O)2的存在,可采用的方法是( AB ) 1L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积 1L水蒸气通过浓硫酸后,测浓硫酸增重的质量 该水蒸气冷凝后,测水的pH 该水蒸气冷凝后,测氢氧原子比 用过量氨水除去Al3+溶液中的少量Fe3+ 将混合气体通过灼热的铜网除去N2中的少量O2 用新制的生石灰(CaO),通过加热蒸馏,以除去乙醇中的少量水 用盐酸除去AgCl中少量的Ag2CO3 银镜反应实验后附有银的试管,可用稀H2SO4清洗 在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次 解析:第一次坩埚,第二次坩埚+药品,第三次反应完的坩埚+剩余药品,第四次为了减小误差,再加热后称量反应完的坩埚+剩余药品 不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗 在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液 稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水 为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,后放入坩锅中 为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸 gSO4微溶; 称量的时候先要称空坩埚的质量,再将晶体放入坩埚中研碎,再称坩埚和晶体的总质量,因为要是先称取一定量的晶体,后放入坩埚中的话,在转移过程中就会出现损失,无法计算. eCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去) (O)_(3) 中发生反应的化学方程式是____________________________________。 中的现象是_______________________________________。 管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。 e3+的操作方法_________________________________________ ______________________________________________________________________。 eCl3·6H2O晶体,设计流程如下: (O)_(3) I中通入Cl2的作用是______________________________________________。 II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括: _____________________________________________________________________。 ③ 该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明) ____________________________________________________________________。
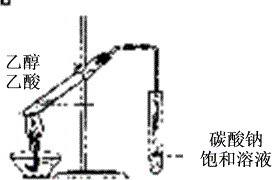
(2010上海)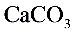 广泛存在于自然界,是一种重要的化工原料。大理石主要成分为
广泛存在于自然界,是一种重要的化工原料。大理石主要成分为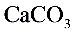 ,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备
,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备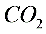 气体。下列装置可用于
气体。下列装置可用于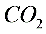 气体的提纯和干燥。
气体的提纯和干燥。
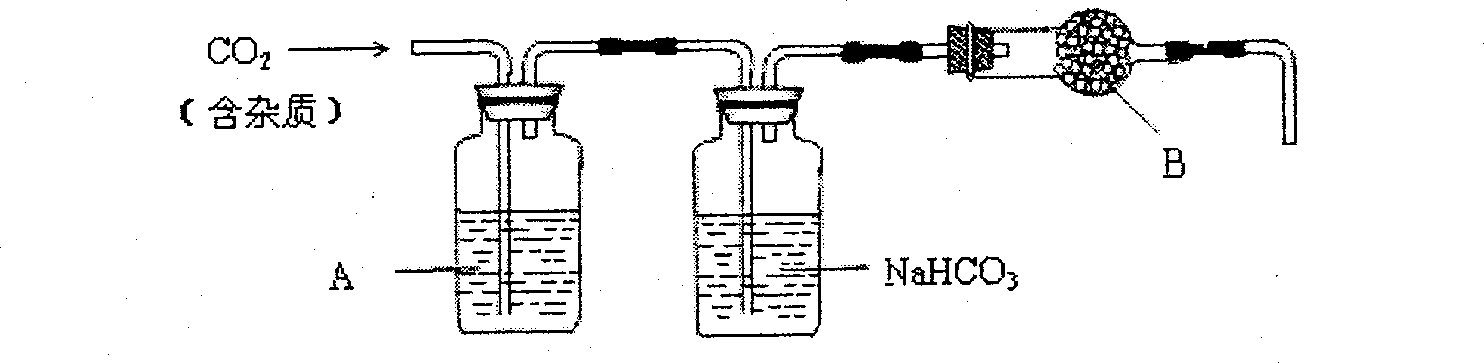
完成下列填空:
1)用浓盐酸配制1:1(体积比)的稀盐酸(约6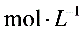 ),应选用的仪器是_____。
),应选用的仪器是_____。
B. 玻璃棒
C. 量筒d.容量瓶
D. 是____溶液,
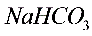 溶液可以吸收_____。
溶液可以吸收_____。E. _____。用这个实验得到的气体测定
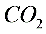 的分子量,如果B物质失效,测定结果____(填“偏高”、“偏低”或“不受影响”)。
的分子量,如果B物质失效,测定结果____(填“偏高”、“偏低”或“不受影响”)。F. 4)一次性饭盒中石蜡(高级烷烃)和
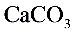 在食物中的溶出量是评价饭盒质量的指标之 一,测定溶出量的主要实验步骤设计如下:
在食物中的溶出量是评价饭盒质量的指标之 一,测定溶出量的主要实验步骤设计如下:G. 剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
______。
氯化钠溶液
稀醋酸
稀硫酸d 正已烷
_____后溶出_______。
_______,说明样品已经恒重。
26(2010).(本题共12分)
2)
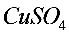 溶液或酸性
溶液或酸性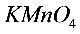 溶液: 吸收HCl气体或吸收酸性气体
溶液: 吸收HCl气体或吸收酸性气体3)无水
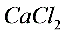 偏低 4)b d
偏低 4)b dOOlg
(05广东)11、下列各组物质仅用蒸馏水不能鉴别出的是
苯、酒精、硝基苯
食盐、烧碱、硝酸铵
蔗糖、硫酸铜粉末、碳酸钙粉末 D、氧化铜、二氧化猛、活性炭
。 A项:苯密度比水小,和水混合后上层是无色透明油状液体,下层是水, 酒精与水任意比例互溶,不分层, 硝基苯密度比水大,和水混合后,上层是水,下层是无色透明油状液体。 B根据3种物质在水中溶解时是吸热、放热还是温度不变可以判断。 C根据3种物质在水中溶解时所致溶液颜色是蓝色、透明、悬浊液(不溶)可以判断出。 唯独D中3种物质无法用蒸馏水分辨。
(05广东)9、下列实验操作与安全事故处理错误的是c
使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
用试管夹从试管底由下往上夹住试管口约
 处,手持试管夹长柄末端,进行加热
处,手持试管夹长柄末端,进行加热制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中
铜与浓硝酸反应制NO2
铜与稀硝酸反应制NO
乙醇与浓硫酸反应制乙烯
氯化钠与浓硫酸反应制HCl
中NO2会溶于水,C中需温度计,HCl溶于水
浓硝酸保存在无色玻璃试剂瓶中
少量的钠保存在煤油中
氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中
新制的氯水通常保存在棕色玻璃试剂瓶中
稀硫酸、氯化钡溶液
硫酸亚铁溶液、氢氧化钠溶液
氯化钠溶液、硝酸银溶液 D 氯化铝溶液、氢氧化钠溶液
配制50 g质量分数为5% NaCl溶液:将45 mL
NaCl的烧杯中,搅拌溶解
制备乙酸乙酯:用如右图所示的实验装置(解析:需要温度计)
鉴定SO
 :向溶液中加入盐酸酸化的氯化钡溶液
:向溶液中加入盐酸酸化的氯化钡溶液鉴别环已烯和苯:将溴的四氯化碳溶液分别滴加到少量环已烯和苯中
除去CO中少量O2:通过灼热的Cu网后收集气体(解析:CO会和O2与Cu生成的CuO反应)
除去K2CO3固体中少量NaHCO3:置于坩埚中加热
除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤(解析:引入了单质溴杂质)
除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
)
滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
璃导管蘸水后,边旋转边向橡皮管中插入
热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量
璃棒蘸取溶液滴到放在表面皿上的pH试纸上
)
加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯
加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯
加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
D )
H2O)2,要确定(H2O)2的存在,可采用的方法是( AB )
1L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
1L水蒸气通过浓硫酸后,测浓硫酸增重的质量
该水蒸气冷凝后,测水的pH
该水蒸气冷凝后,测氢氧原子比
用过量氨水除去Al3+溶液中的少量Fe3+
将混合气体通过灼热的铜网除去N2中的少量O2
用新制的生石灰(CaO),通过加热蒸馏,以除去乙醇中的少量水
用盐酸除去AgCl中少量的Ag2CO3
银镜反应实验后附有银的试管,可用稀H2SO4清洗
在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
解析:第一次坩埚,第二次坩埚+药品,第三次反应完的坩埚+剩余药品,第四次为了减小误差,再加热后称量反应完的坩埚+剩余药品
不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗
在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液
稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,后放入坩锅中
为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸
gSO4微溶; 称量的时候先要称空坩埚的质量,再将晶体放入坩埚中研碎,再称坩埚和晶体的总质量,因为要是先称取一定量的晶体,后放入坩埚中的话,在转移过程中就会出现损失,无法计算.
eCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
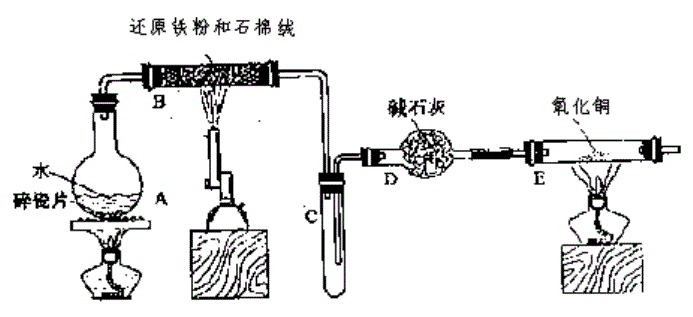
中发生反应的化学方程式是____________________________________。
中的现象是_______________________________________。
管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。
e3+的操作方法_________________________________________
______________________________________________________________________。
eCl3·6H2O晶体,设计流程如下:
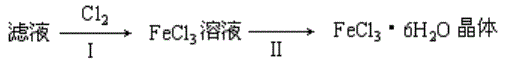
I中通入Cl2的作用是______________________________________________。
II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_____________________________________________________________________。
③ 该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
____________________________________________________________________。
题目解答
答案
此题选 D 。 B 根据 3 种物质在水中溶解时是吸热、放热还是温度不变可以判断。 C 根据 3 种物质在水中溶解时所致溶液颜色是蓝色、透明、悬浊液(不溶)可以判断出。 唯独 D 中 3 种物质无法用蒸馏水分辨。 解析:第一次坩埚,第二次坩埚 + 药品,第三次反应完的坩埚 + 剩余药品,第四次为了减小误差, 再加热后称量反应完的坩埚 + 剩余药品 ( 05 北京) 12 .下列实验操作中,先后顺序正确的是 D A .稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水 B .为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,后放入坩锅中 C .为检验酸性溶液中的 Cl - 和 SO 4 2 - ,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 D .在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸 解 析: AgSO4 微溶 ; 称量的时候先要称空 坩埚 的质量 , 再将晶体放入 坩埚 中研碎 , 再称 坩埚 和晶体的总质量 , 因为要是先称取一定量的晶体,后放入坩埚中的话 , 在转移过程中就会出现损失 , 无法计算 . ( 05 北京)