数据处理依据实验记录数据计算每次测得的食醋中醋酸的质量m(CH3COOH)=c(NaOH)·V(NaOH)·M(CH3COOH),则100 mL食醋中所含醋酸的质量为:m′(CH3COOH)=c(NaOH)·V(NaOH)·M(CH3COOH)××,根据3次接近的平行测定值,可计算食醋中的总酸含量的平均值。思考2:酸碱恰好中和反应时就是滴定终点吗?此时溶液一定显中性吗?提示 滴定终点是指酸碱中和反应时指示剂颜色恰好变化的点,不一定就是酸碱恰好中和时的点(但在误差允许范围之内),此时溶液不一定显中性,如NaOH与CH3COOH恰好中和时溶液显碱性。点拨一、滴定管和移液管的使用1.滴定管及其使用(1)滴定管的优点是易于控制所滴加液体的流量、读数比较精确,滴定管的最小刻度为0.1 mL,可估读到0.01 mL(如20.18 mL,最后一位是估计值)。(2)中和滴定中使用的滴定管分酸式和碱式两种,使用时不能混用。酸式滴定管还可用于盛其他酸性或具有强氧化性的物质,碱式滴定管还能用于盛装其他碱性物质。(3)中和滴定中有关仪器的洗涤。滴定管在使用前经检查不漏水后要进行洗涤,须先用自来水洗(必要时用特殊试剂洗)再用蒸馏水洗,然后再用待盛液润洗2~3次。但锥形瓶用蒸馏水洗净后不能再用待盛液润洗,否则将会引起误差。(4)要注意滴定管的刻度,0刻度在上,往下越来越大,全部容积大于它的最大刻度值,因为下端有一部分没有刻度。滴定时,所用溶液不得超过最低刻度,也不得一次滴定使用两滴定管酸(或碱),也不得中途向滴定管中添加试剂。2.移液管的使用移液管是准确量取一定体积液体的量具。吸取液体时,左手拿洗耳球,右手将移液管插入溶液中吸取,当溶液吸至标线以上时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即按紧管口。将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管(管尖残留的液体不要吹出,管上注明需吹出的例外)。移液管使用完毕后,应立即洗净,放在移液管架上。点拨二、中和滴定实验注意事项1.用NaOH溶液滴定时,实际测出的是总酸量。分析结果用含量最多的醋酸表示。2.由于是强碱滴定弱酸,滴定的pH突变在碱性范围内,理论上滴定终点的pH在8.7左右。通常选用酚酞为指示剂,滴至溶液呈粉红色且30 s内不褪色,表明滴定达终点。3.最好用白醋。若样品为颜色较深的食醋,需用蒸馏水稀释5倍以上,直到溶液颜色变得很浅、无碍于观察酚酞溶液的颜色变化为止。如果经稀释或活性炭脱色后颜色仍较深,则此品牌食醋不适于用酸碱指示剂滴定法测定酸含量。4.为了减小随机误差,应适当增加平行测定次数,通常平行测定三次。5.在一组测定数据中,若某个实验数据与其他数据相差较大,这一数据称为异常值,一般将其舍弃。为了保证测定结果的准确度,应重新滴定一次。点拨三、中和滴定中常见的误差分析(以用标准盐酸滴定待测NaOH溶液为例)步骤操作c(NaOH)洗涤未用标准溶液润洗滴定管偏高锥形瓶用待测溶液润洗偏高未用待测溶液润洗取用待测液的滴定管偏低锥形瓶洗净后瓶内还残留有少量蒸馏水无影响读数滴定前仰视读数或滴定后俯视读数偏低滴定前俯视读数或滴定后仰视读数偏高操作不当滴定完毕后立即读数,半分钟后颜色又褪去偏低滴定前滴定管尖嘴部分有气泡偏高滴定过程中振荡时有液滴溅出偏低滴定过程中,锥形瓶内加少量蒸馏水无影响所配标准盐酸的物质的量浓度偏大偏低特别提醒 读数误差可以用画图的形式来理解和记忆。如开始读数仰视,滴定完毕读数俯视,如图Ⅰ;开始读数俯视,滴定完毕读数仰视,如图Ⅱ。.
数据处理
依据实验记录数据计算每次测得的食醋中醋酸的质量
m(CH3COOH)=c(NaOH)·V(NaOH)·M(CH3COOH),
则100 mL食醋中所含醋酸的质量为:
m′(CH3COOH)=c(NaOH)·V(NaOH)·M(CH3COOH)×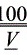 ×
×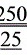 ,
,
根据3次接近的平行测定值,可计算食醋中的总酸含量的平均值。
思考2:酸碱恰好中和反应时就是滴定终点吗?此时溶液一定显中性吗?
提示 滴定终点是指酸碱中和反应时指示剂颜色恰好变化的点,不一定就是酸碱恰好中和时的点(但在误差允许范围之内),此时溶液不一定显中性,如NaOH与CH3COOH恰好中和时溶液显碱性。

点拨一、滴定管和移液管的使用
1.滴定管及其使用
(1)滴定管的优点是易于控制所滴加液体的流量、读数比较精确,滴定管的最小刻度为0.1 mL,可估读到0.01 mL(如20.18 mL,最后一位是估计值)。
(2)中和滴定中使用的滴定管分酸式和碱式两种,使用时不能混用。酸式滴定管还可用于盛其他酸性或具有强氧化性的物质,碱式滴定管还能用于盛装其他碱性物质。
(3)中和滴定中有关仪器的洗涤。滴定管在使用前经检查不漏水后要进行洗涤,须先用自来水洗(必要时用特殊试剂洗)再用蒸馏水洗,然后再用待盛液润洗2~3次。但锥形瓶用蒸馏水洗净后不能再用待盛液润洗,否则将会引起误差。
(4)要注意滴定管的刻度,0刻度在上,往下越来越大,全部容积大于它的最大刻度值,因为下端有一部分没有刻度。滴定时,所用溶液不得超过最低刻度,也不得一次滴定使用两滴定管酸(或碱),也不得中途向滴定管中添加试剂。
2.移液管的使用
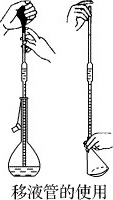 移液管是准确量取一定体积液体的量具。吸取液体时,左手拿洗耳球,右手将移液管插入溶液中吸取,当溶液吸至标线以上时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即按紧管口。将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管(管尖残留的液体不要吹出,管上注明需吹出的例外)。移液管使用完毕后,应立即洗净,放在移液管架上。
移液管是准确量取一定体积液体的量具。吸取液体时,左手拿洗耳球,右手将移液管插入溶液中吸取,当溶液吸至标线以上时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即按紧管口。将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管(管尖残留的液体不要吹出,管上注明需吹出的例外)。移液管使用完毕后,应立即洗净,放在移液管架上。
点拨二、中和滴定实验注意事项
1.用NaOH溶液滴定时,实际测出的是总酸量。分析结果用含量最多的醋酸表示。
2.由于是强碱滴定弱酸,滴定的pH突变在碱性范围内,理论上滴定终点的pH在8.7左右。通常选用酚酞为指示剂,滴至溶液呈粉红色且30 s内不褪色,表明滴定达终点。
3.最好用白醋。若样品为颜色较深的食醋,需用蒸馏水稀释5倍以上,直到溶液颜色变得很浅、无碍于观察酚酞溶液的颜色变化为止。如果经稀释或活性炭脱色后颜色仍较深,则此品牌食醋不适于用酸碱指示剂滴定法测定酸含量。
4.为了减小随机误差,应适当增加平行测定次数,通常平行测定三次。
5.在一组测定数据中,若某个实验数据与其他数据相差较大,这一数据称为异常值,一般将其舍弃。为了保证测定结果的准确度,应重新滴定一次。
点拨三、中和滴定中常见的误差分析(以用标准盐酸滴定待测NaOH溶液为例)
步骤
操作
c(NaOH)
洗涤
未用标准溶液润洗滴定管
偏高
锥形瓶用待测溶液润洗
偏高
未用待测溶液润洗取用待测液的滴定管
偏低
锥形瓶洗净后瓶内还残留有少量蒸馏水
无影响
读数
滴定前仰视读数或滴定后俯视读数
偏低
滴定前俯视读数或滴定后仰视读数
偏高
操作不当
滴定完毕后立即读数,半分钟后颜色又褪去
偏低
滴定前滴定管尖嘴部分有气泡
偏高
滴定过程中振荡时有液滴溅出
偏低
滴定过程中,锥形瓶内加少量蒸馏水
无影响
所配标准盐酸的物质的量浓度偏大
偏低
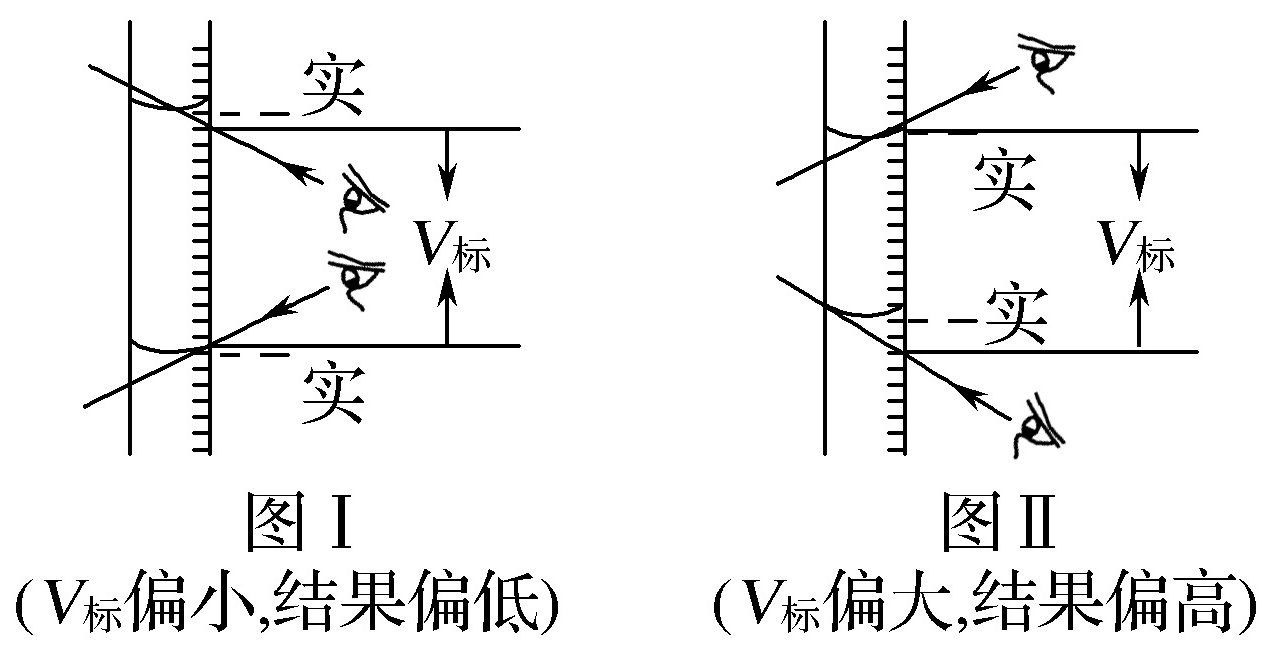
特别提醒 读数误差可以用画图的形式来理解和记忆。如开始读数仰视,滴定完毕读数俯视,如图Ⅰ;开始读数俯视,滴定完毕读数仰视,如图Ⅱ。
题目解答
答案
答案 实验一:(1)胶头滴管 250 mL容量瓶
(2)0.200 0 mol·L-1 实验二:(1)0.010 0 mol·L-1醋酸溶液的pH大于2(或醋酸稀释10倍时,pH的变化值小于1) (2)增大 实验三:用pH计(或pH试纸)测定相同浓度的醋酸在几种不同温度时的pH
.