题目
A-B混合物在80.的汽液平衡数据表明,在0<xB≤0.02的范围内,B组分符合Henry定律,且B的分压可表示为pB=6..66xBkPa。另已知两组分的饱和蒸汽压为PsA=13..32ka、PsB=33.33kPa,求80℃和xB=0.01时的平衡压力和汽相组成;若该液相是理想溶液,汽相是理想气体,再求80℃和xB=0.01时的平衡压力和汽相组成。
A-B混合物在8
0.的汽液平衡数据表明,在0<xB≤0.02的范围内,B组分符合Henry定律,且B的分压可表示为pB=
6..66xBkPa。另已知两组分的饱和蒸汽压为PsA=1
3..32ka、PsB=33.33kPa,求80℃和xB=0.01时的平衡压力和汽相组成;若该液相是理想溶液,汽相是理想气体,再求80℃和xB=0.01时的平衡压力和汽相组成。
0.的汽液平衡数据表明,在0<xB≤0.02的范围内,B组分符合Henry定律,且B的分压可表示为pB=
6..66xBkPa。另已知两组分的饱和蒸汽压为PsA=1
3..32ka、PsB=33.33kPa,求80℃和xB=0.01时的平衡压力和汽相组成;若该液相是理想溶液,汽相是理想气体,再求80℃和xB=0.01时的平衡压力和汽相组成。
题目解答
答案

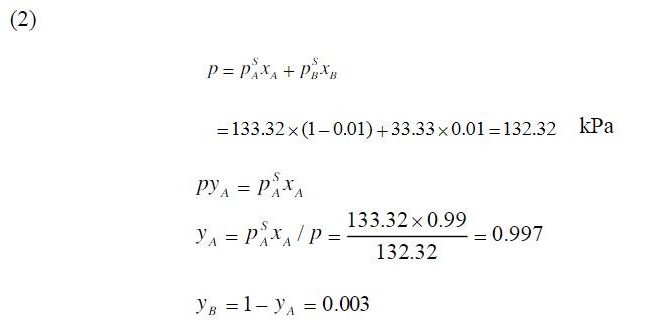
解析
考查要点:本题主要考察汽液平衡计算,涉及Henry定律和理想溶液两种情况下的平衡压力及汽相组成计算。
解题思路:
- Henry定律适用条件:当液相中B组分浓度极低(x_B ≤0.02)时,B的分压遵循Henry定律,即p_B = k_H x_B,而A组分的分压遵循拉乌尔定律。
- 理想溶液条件:当液相为理想溶液时,两组分均遵循拉乌尔定律,分压分别为p_A = P_A^s x_A,p_B = P_B^s x_B。
- 总压力与汽相组成:总压力为各组分分压之和,汽相组成由分压占总压力的比例确定。
关键点:
- 区分两种模型:Henry定律适用于低浓度B组分,理想溶液模型适用于所有浓度。
- 分压计算:根据模型选择正确的分压公式。
- 汽相组成计算:严格遵循分压与总压力的比例关系。
第(1)题:液相符合Henry定律
计算B组分分压
根据Henry定律,B的分压为:
$p_B = k_H x_B = 66.66 \times 0.01 = 0.6666 \, \text{kPa}$
计算A组分分压
A组分遵循拉乌尔定律,分压为:
$p_A = P_A^s x_A = 133.32 \times (1 - 0.01) = 131.9868 \, \text{kPa}$
计算总压力
总压力为两组分分压之和:
$P = p_A + p_B = 131.9868 + 0.6666 = 132.6534 \, \text{kPa} \approx 132.65 \, \text{kPa}$
计算汽相组成
- B组分摩尔分数:
$y_B = \frac{p_B}{P} = \frac{0.6666}{132.65} \approx 0.005$ - A组分摩尔分数:
$y_A = 1 - y_B = 1 - 0.005 = 0.995$
第(2)题:液相为理想溶液
计算A组分分压
$p_A = P_A^s x_A = 133.32 \times (1 - 0.01) = 131.9868 \, \text{kPa}$
计算B组分分压
$p_B = P_B^s x_B = 33.33 \times 0.01 = 0.3333 \, \text{kPa}$
计算总压力
$P = p_A + p_B = 131.9868 + 0.3333 = 132.3201 \, \text{kPa} \approx 132.32 \, \text{kPa}$
计算汽相组成
- A组分摩尔分数:
$y_A = \frac{p_A}{P} = \frac{131.9868}{132.32} \approx 0.9975$ - B组分摩尔分数:
$y_B = 1 - y_A = 1 - 0.9975 = 0.0025$