一定量的镁和氧化镁的混合物中镁元素的质量分数为72%,取10g加入足量的稀硫酸溶液,再向溶解入足量的氢氧化钠溶液,得到沉淀的质量为( )A.10gB.17.4gC.7.2gD.5g
一定量的镁和氧化镁的混合物中镁元素的质量分数为72%,取10g加入足量的稀硫酸溶液,再向溶解入足量的氢氧化钠溶液,得到沉淀的质量为( )
A.10g
B.17.4g
C.7.2g
D.5g
题目解答
答案
10gMg粉和MgO组成的混合物中,镁元素的质量为:10g×72%=7.2g,7.2g镁元素完全转化到了硫酸镁中;硫酸镁中,镁和硫酸镁的质量比为24:120;
设所得溶液中溶质硫酸镁的质量为X,则有24:120=7.2:X,故解得X为36g,而硫酸镁会与氢氧化钠反应生成氢氧化镁沉淀和硫酸钠,即设氢氧化镁沉淀的质量为y,故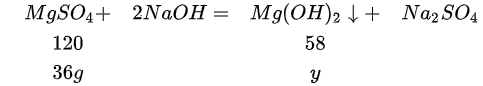 ,故列式
,故列式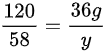 ,解得y=17.4g,故氢氧化镁沉淀的质量为17.4g,所以答案为:B。
,解得y=17.4g,故氢氧化镁沉淀的质量为17.4g,所以答案为:B。
解析
考查要点:本题主要考查质量守恒定律在化学反应中的应用,特别是元素质量守恒在混合物反应中的处理方法。关键在于理解镁元素在反应过程中的传递路径,并利用元素质量守恒进行计算。
解题核心思路:
- 确定镁元素的总量:混合物中镁元素的总质量由质量分数直接计算得出。
- 元素守恒:镁元素最终全部转化为硫酸镁中的镁,再通过硫酸镁与氢氧化钠的反应转化为氢氧化镁沉淀。
- 比例关系:利用硫酸镁中镁的质量占比,计算硫酸镁的总质量;再通过硫酸镁与氢氧化镁的摩尔关系,求出沉淀质量。
破题关键点:
- 忽略具体反应步骤,直接通过镁元素的质量守恒建立关系。
- 硫酸镁与氢氧化镁的摩尔比为1:1,简化计算过程。
步骤1:计算混合物中镁元素的总质量
混合物质量为10g,镁元素的质量分数为72%,因此:
$\text{镁元素质量} = 10\, \text{g} \times 72\% = 7.2\, \text{g}$
步骤2:确定硫酸镁的总质量
镁元素全部进入硫酸镁中。硫酸镁(MgSO₄)中镁的质量占比为:
$\frac{24}{120} = \frac{1}{5}$
设硫酸镁的质量为$X$,则:
$\frac{24}{120} = \frac{7.2}{X} \implies X = 7.2 \times 5 = 36\, \text{g}$
步骤3:计算氢氧化镁沉淀的质量
硫酸镁与氢氧化钠反应生成氢氧化镁(Mg(OH)₂):
$\text{MgSO₄} + 2\text{NaOH} \rightarrow \text{Mg(OH)₂↓} + \text{Na₂SO₄}$
硫酸镁的物质的量为:
$\frac{36\, \text{g}}{120\, \text{g/mol}} = 0.3\, \text{mol}$
生成的氢氧化镁物质的量也为0.3 mol,其质量为:
$0.3\, \text{mol} \times 58\, \text{g/mol} = 17.4\, \text{g}$