题目
在间歇釜式反应器中进行如下反应, k1 → P+R-|||-A k2 S 实验测得50℃时cP/cS恒为2,当反应10min后,A的转化率为0.50,反应时间延长一倍,转化率为0.75,求k1和k2的值,又当温度提高10℃,测得cP/cS=3,试问哪个反应活化能大?两个反应活化能差多少?
在间歇釜式反应器中进行如下反应,
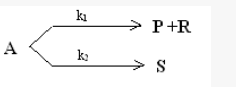 实验测得50℃时cP/cS恒为2,当反应10min后,A的转化率为0.50,反应时间延长一倍,转化率为0.75,求k1和k2的值,又当温度提高10℃,测得cP/cS=3,试问哪个反应活化能大?两个反应活化能差多少?
实验测得50℃时cP/cS恒为2,当反应10min后,A的转化率为0.50,反应时间延长一倍,转化率为0.75,求k1和k2的值,又当温度提高10℃,测得cP/cS=3,试问哪个反应活化能大?两个反应活化能差多少?
题目解答
答案
k1=0.0462min-1 k2=0.0231min-1 △E=36.28kJ/mol
解析
步骤 1:确定反应速率方程
反应速率方程为:d[A]/dt = -k1[A] - k2[A],其中k1和k2分别是反应A→P+R和A→S的速率常数。
步骤 2:利用转化率计算速率常数
当反应10min后,A的转化率为0.50,反应时间延长一倍,转化率为0.75。根据转化率计算速率常数。
步骤 3:计算k1和k2
利用转化率计算速率常数,得到k1和k2的值。
步骤 4:计算活化能差
当温度提高10℃,测得cP/cS=3,利用阿伦尼乌斯方程计算活化能差。
反应速率方程为:d[A]/dt = -k1[A] - k2[A],其中k1和k2分别是反应A→P+R和A→S的速率常数。
步骤 2:利用转化率计算速率常数
当反应10min后,A的转化率为0.50,反应时间延长一倍,转化率为0.75。根据转化率计算速率常数。
步骤 3:计算k1和k2
利用转化率计算速率常数,得到k1和k2的值。
步骤 4:计算活化能差
当温度提高10℃,测得cP/cS=3,利用阿伦尼乌斯方程计算活化能差。