题目
西交《化学反应工程》(四)第三章 釜式反应器例题讲解例一:在等温间歇反应器中进行乙酸乙酯皂化反应:CH3COOC2H5+3COOC2H5+NaOH→CH3COONa+C22115+NOUN ICH3NaOH→CH3COONaCOONa T C2N 5 OHCH3COOC2H5+3COOC2H5+NaOH→CH3COONa+C22115+NOUN ICH3NaOH→CH3COONaCOONa T C2N 5 OH该反应对乙酸乙酯及氢氧化钠均为一级。反应开始时乙酸乙酯及氢氧化钠的浓度均为 mol/L,反应速率常数等于 L/(mol min)。试求乙酸乙酯转化率分别达到 80%、90%和 95%时的反应时间。
西交《化学反应工程》(四)
第三章 釜式反应器
例题讲解
例一:在等温间歇反应器中进行乙酸乙酯皂化反应:


该反应对乙酸乙酯及氢氧化钠均为一级。反应开始时乙酸乙酯及氢氧化钠的浓度均为 mol/L,反应速率常数等于 L/(mol min)。试求乙酸乙酯转化率分别达到 80%、90%和 95%时的反应时间。
题目解答
答案
解:
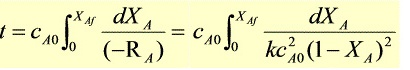
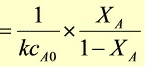
例二:在一个体积为300 L的反应器中,86℃等温下将浓度为m 的过氧化氢异丙苯溶液分解:
生产苯酚和丙酮。该反应为1级反应,反应温度下反应速率常数等于 s,最终转化率达%,试计算苯酚的产量。
(1)如果这个反应器是间歇操作反应器,
并设辅助操作时间为15 min;
(2)如果是全混反应器;
(3)试比较上述两问的计算结果;
(4)若过氧化氢异丙苯浓度增加一倍,
其他条件不变,结果怎样?
解:(1)
[Ln 1/(1-XA)]/k==
V=Q0(t+t0)=300 L
Q=300/= L/min
苯酚浓度C=CA0XA=×= mol/L
苯酚产量QrC=×=min=h
(2)全混流反应器
V苯酚= Q CX/[k C(1-X)]= Q X/[k(1-X)]
Q= V苯酚k(1-X)/ X= L/s= L/min
苯酚产量QC=×=min=h
(3)说明全混釜的产量小于间歇斧的产量,这是由于全混釜中 反应物浓度低,反应速率慢的原因。
(4)由于该反应为一级反应,由上计算可知,无论式间歇釜或全混流反应器,其原料处理量不变,但由于CA0浓度增加一倍,故C苯酚也增加一倍,故上述两个反应器中苯酚的产量均增加一倍。
解析
步骤 1:确定反应速率方程
反应对乙酸乙酯(A)和氢氧化钠(B)均为一级反应,因此反应速率方程为:
$$ r = kC_A C_B $$
其中,$k$ 是反应速率常数,$C_A$ 和 $C_B$ 分别是乙酸乙酯和氢氧化钠的浓度。
步骤 2:确定转化率与时间的关系
由于反应开始时乙酸乙酯和氢氧化钠的浓度均为 $C_{A0}$,且反应速率常数为 $k$,则反应速率方程可以写为:
$$ r = kC_{A0}^2 $$
反应的转化率 $X_A$ 与时间 $t$ 的关系为:
$$ \frac{1}{kC_{A0}} \times \frac{X_A}{1-X_A} = t $$
步骤 3:计算不同转化率下的反应时间
将给定的转化率代入上述方程,计算出相应的反应时间。
- 当 $X_A = 80\% = 0.8$ 时:
$$ t = \frac{1}{kC_{A0}} \times \frac{0.8}{1-0.8} $$
- 当 $X_A = 90\% = 0.9$ 时:
$$ t = \frac{1}{kC_{A0}} \times \frac{0.9}{1-0.9} $$
- 当 $X_A = 95\% = 0.95$ 时:
$$ t = \frac{1}{kC_{A0}} \times \frac{0.95}{1-0.95} $$
反应对乙酸乙酯(A)和氢氧化钠(B)均为一级反应,因此反应速率方程为:
$$ r = kC_A C_B $$
其中,$k$ 是反应速率常数,$C_A$ 和 $C_B$ 分别是乙酸乙酯和氢氧化钠的浓度。
步骤 2:确定转化率与时间的关系
由于反应开始时乙酸乙酯和氢氧化钠的浓度均为 $C_{A0}$,且反应速率常数为 $k$,则反应速率方程可以写为:
$$ r = kC_{A0}^2 $$
反应的转化率 $X_A$ 与时间 $t$ 的关系为:
$$ \frac{1}{kC_{A0}} \times \frac{X_A}{1-X_A} = t $$
步骤 3:计算不同转化率下的反应时间
将给定的转化率代入上述方程,计算出相应的反应时间。
- 当 $X_A = 80\% = 0.8$ 时:
$$ t = \frac{1}{kC_{A0}} \times \frac{0.8}{1-0.8} $$
- 当 $X_A = 90\% = 0.9$ 时:
$$ t = \frac{1}{kC_{A0}} \times \frac{0.9}{1-0.9} $$
- 当 $X_A = 95\% = 0.95$ 时:
$$ t = \frac{1}{kC_{A0}} \times \frac{0.95}{1-0.95} $$