题目
铁的回复激活能为88.9 kJ/mol,如果经冷变形的铁在400℃进行回复处理,使其残留加工硬化为60%需160分钟,问在450℃回复处理至同样效果需要多少时间?
铁的回复激活能为88.9 kJ/mol,如果经冷变形的铁在400℃进行回复处理,使其残留加工硬化为60%需160分钟,问在450℃回复处理至同样效果需要多少时间?
题目解答
答案
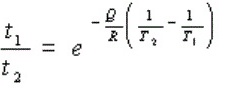
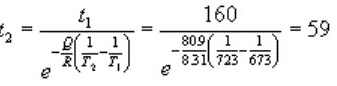 (分)
(分)
解析
步骤 1:确定已知条件
已知铁的回复激活能为88.9 kJ/mol,冷变形铁在400℃(673K)进行回复处理,使其残留加工硬化为60%需160分钟。需要计算在450℃(723K)回复处理至同样效果需要多少时间。
步骤 2:应用Arrhenius方程
Arrhenius方程描述了温度对反应速率的影响,其形式为:$\dfrac{{t}_{1}}{{t}_{2}}={e}^{-\dfrac{\theta}{R}(\dfrac{1}{{T}_{2}}-\dfrac{1}{{T}_{1}})}$,其中${t}_{1}$和${t}_{2}$分别为在温度${T}_{1}$和${T}_{2}$下达到相同效果所需的时间,$\theta$为激活能,$R$为气体常数(8.314 J/mol·K)。
步骤 3:代入已知条件计算
将已知条件代入Arrhenius方程,计算在450℃(723K)回复处理至同样效果需要的时间${t}_{2}$。
${t}_{2}=\dfrac{{t}_{1}}{{e}^{-\dfrac{\theta}{R}(\dfrac{1}{{T}_{2}}-\dfrac{1}{{T}_{1}})}}=\dfrac{160}{{e}^{-\dfrac{88900}{8.314}(\dfrac{1}{723}-\dfrac{1}{673})}}$
步骤 4:计算结果
计算上述表达式,得到${t}_{2}$的值。
${t}_{2}=\dfrac{160}{{e}^{-\dfrac{88900}{8.314}(\dfrac{1}{723}-\dfrac{1}{673})}}=\dfrac{160}{{e}^{-\dfrac{88900}{8.314}(-0.00043)}}=\dfrac{160}{{e}^{4.66}}=59$(分钟)
已知铁的回复激活能为88.9 kJ/mol,冷变形铁在400℃(673K)进行回复处理,使其残留加工硬化为60%需160分钟。需要计算在450℃(723K)回复处理至同样效果需要多少时间。
步骤 2:应用Arrhenius方程
Arrhenius方程描述了温度对反应速率的影响,其形式为:$\dfrac{{t}_{1}}{{t}_{2}}={e}^{-\dfrac{\theta}{R}(\dfrac{1}{{T}_{2}}-\dfrac{1}{{T}_{1}})}$,其中${t}_{1}$和${t}_{2}$分别为在温度${T}_{1}$和${T}_{2}$下达到相同效果所需的时间,$\theta$为激活能,$R$为气体常数(8.314 J/mol·K)。
步骤 3:代入已知条件计算
将已知条件代入Arrhenius方程,计算在450℃(723K)回复处理至同样效果需要的时间${t}_{2}$。
${t}_{2}=\dfrac{{t}_{1}}{{e}^{-\dfrac{\theta}{R}(\dfrac{1}{{T}_{2}}-\dfrac{1}{{T}_{1}})}}=\dfrac{160}{{e}^{-\dfrac{88900}{8.314}(\dfrac{1}{723}-\dfrac{1}{673})}}$
步骤 4:计算结果
计算上述表达式,得到${t}_{2}$的值。
${t}_{2}=\dfrac{160}{{e}^{-\dfrac{88900}{8.314}(\dfrac{1}{723}-\dfrac{1}{673})}}=\dfrac{160}{{e}^{-\dfrac{88900}{8.314}(-0.00043)}}=\dfrac{160}{{e}^{4.66}}=59$(分钟)