17.在温度为273.15K下,1mol氩气从体积为22.41L膨胀至50.00L,试求下列两种过程的-|||-Q、W、 △U、 Delta (H)_(0) 已知氩气的等压摩尔热容 _(pcdot m)=20.79j/(molcdot k) (氩气视为理想气体)。-|||-(1)等温可逆过程;-|||-(2)绝热可逆过程。

题目解答
答案
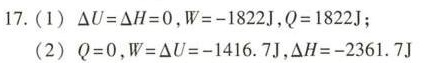
解析
考查要点:本题主要考查理想气体在等温可逆过程和绝热可逆过程中的热力学量(Q、W、ΔU、ΔH)的计算,需熟练掌握不同过程的特点及公式应用。
解题核心思路:
- 等温可逆过程:
- 关键点:温度不变,内能(ΔU)和焓(ΔH)变化为0;功(W)由体积变化计算,热量(Q)与功等值反号。
- 绝热可逆过程:
- 关键点:无热交换(Q=0),功(W)等于内能变化(ΔU);需通过绝热方程计算终态温度,再结合热容计算ΔU和ΔH。
破题关键:
- 明确区分两种过程的特性,选择对应的公式;
- 等温过程直接利用体积比计算功;
- 绝热过程需先求终态温度,再计算热力学量。
第(1)题:等温可逆过程
计算功(W)
等温可逆过程的功公式为:
$W = -nRT \ln \frac{V_2}{V_1}$
代入数据:
- $n=1 \, \text{mol}$,$R=8.314 \, \text{J/(mol·K)}$,$T=273.15 \, \text{K}$,
- $V_1=22.41 \, \text{L}$,$V_2=50.00 \, \text{L}$,
$W = -1 \cdot 8.314 \cdot 273.15 \cdot \ln \frac{50.00}{22.41} \approx -1822 \, \text{J}$
计算热量(Q)
等温过程内能不变($\Delta U = 0$),由热力学第一定律 $Q = \Delta U - W$,得:
$Q = -W = 1822 \, \text{J}$
内能与焓变
等温条件下:
$\Delta U = 0, \quad \Delta H = 0$
第(2)题:绝热可逆过程
计算终态温度(T₂)
绝热过程满足:
$T_1 V_1^{\gamma-1} = T_2 V_2^{\gamma-1}$
其中 $\gamma = \frac{C_{p,m}}{C_{v,m}} = \frac{20.79}{20.79 - 8.314} \approx 1.666$,代入数据:
$T_2 = T_1 \left( \frac{V_1}{V_2} \right)^{\gamma-1} = 273.15 \cdot \left( \frac{22.41}{50.00} \right)^{0.666} \approx 160 \, \text{K}$
计算内能变化(ΔU)
$\Delta U = n C_{v,m} \Delta T = 1 \cdot (20.79 - 8.314) \cdot (160 - 273.15) \approx -1416.7 \, \text{J}$
计算功(W)
绝热过程 $\Delta U = W$,故:
$W = -1416.7 \, \text{J}$
计算焓变(ΔH)
$\Delta H = n C_{p,m} \Delta T = 1 \cdot 20.79 \cdot (160 - 273.15) \approx -2361.7 \, \text{J}$
热量(Q)
绝热过程无热交换:
$Q = 0$