7.计算下列电极在298K时的电极电势:-|||-(1) |(H)^+(1.0times (10)^-2molcdot (L)^-1) ^2+(1.0times (10)^-4molcdot (L)^-1), (Mn{O)_(4)}^-(0.10molcdot (L)^-1)-|||-(2) lg ,AgCl(s)|(Cl)^-(1.0times (10)^-2molcdot (L)^-1) 提示:电极反应为 (s)+(e)^-leftharpoons Ag(s)+(Cl)^--|||-(3)Pt,O2(10.0 kPa)|OH^-(1.0 ×10^(-2)moL·L^(-1))
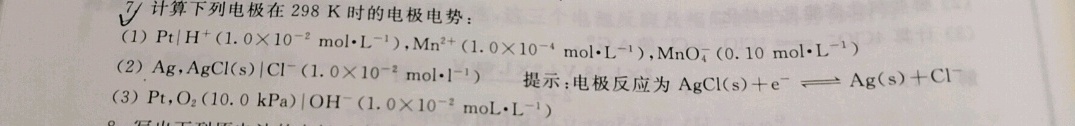
题目解答
答案

解析
考查要点:本题主要考查电极电势的计算,涉及Nernst方程的应用,需根据具体电极反应式确定各物质的浓度、分压及电子转移数,进而修正标准电极电势。
解题思路:
- 确定电极反应式:根据题目描述或提示,写出对应的电极反应式。
- 查找标准电极电势:查阅标准条件下的电极电势值(E°)。
- 应用Nernst方程:将实际条件下的浓度、分压代入Nernst方程,计算实际电极电势。
关键点:
- 反应式方向:确保反应式与电极类型(氧化或还原)一致。
- 气体分压标准化:气体分压需除以标准压力(100 kPa)后再代入计算。
- 对数运算:注意浓度、分压的指数关系及对数符号。
(1) $Pt|H^+(1.0\times10^{-2}), Mn^{2+}(1.0\times10^{-4}), MnO_4^-(0.10)$
确定电极反应
高锰酸根在酸性条件下的还原反应为:
$MnO_4^- + 8H^+ + 5e^- \rightarrow Mn^{2+} + 4H_2O$
标准电极电势
查表得标准电极电势 $E^\circ = 1.51\,V$。
应用Nernst方程
反应商 $Q = \frac{[Mn^{2+}]}{[MnO_4^-][H^+]^8}$,代入数据:
$Q = \frac{1.0\times10^{-4}}{0.10 \cdot (1.0\times10^{-2})^8} = \frac{1.0\times10^{-4}}{1.0\times10^{-18}} = 1.0\times10^{14}$
Nernst方程:
$E = E^\circ - \frac{0.05916}{5} \lg Q$
计算得:
$E = 1.51 - \frac{0.05916}{5} \lg(1.0\times10^{14}) = 1.51 - 0.05916 \times 2.8 = 1.36\,V$
(2) $AgCl(s)|Cl^-(1.0\times10^{-2})$
确定电极反应
反应式为:
$AgCl(s) + e^- \rightarrow Ag(s) + Cl^-$
标准电极电势
查表得 $E^\circ = 0.222\,V$。
应用Nernst方程
反应商 $Q = [Cl^-]$,代入数据:
$E = E^\circ - \frac{0.05916}{1} \lg(1.0\times10^{-2}) = 0.222 - 0.05916 \times (-2) = 0.341\,V$
(3) $Pt, O_2(10.0\,kPa)|OH^-(1.0\times10^{-2})$
确定电极反应
氧的还原反应为:
$O_2 + 2H_2O + 4e^- \rightarrow 4OH^-$
标准电极电势
查表得 $E^\circ = 0.401\,V$(碱性条件)。
应用Nernst方程
反应商 $Q = \frac{[OH^-]^4}{P_{O_2}/P^\circ}$,其中 $P^\circ = 100\,kPa$:
$Q = \frac{(1.0\times10^{-2})^4}{10/100} = \frac{1.0\times10^{-8}}{0.1} = 1.0\times10^{-7}$
Nernst方程:
$E = E^\circ - \frac{0.05916}{4} \lg Q$
计算得:
$E = 0.401 - \frac{0.05916}{4} \lg(1.0\times10^{-7}) = 0.401 - 0.05916 \times (-1.75) = 0.505\,V$