已知酸性高锰酸钾溶液可以和草酸钠、二氧化硫等物质发生氧化还原反应.(1)酸性高锰酸钾溶液和草酸钠反应的离子方程式为:MnO+C2O+H+→CO2↑+Mn2++H2O(未配平).现称取草酸钠(Na2C2O4)样品1.34 g溶于稀硫酸中,然后用0。20 mol·L-1的高锰酸钾溶液滴定(其中的杂质不跟高锰酸钾和稀硫酸反应),达到终点时消耗了15。00 mL的高锰酸钾溶液.①KMnO4溶液应盛放在______(填“酸”或“碱”)式滴定管中。②判断滴定达到终点时的现象是______。③样品中草酸钠的质量分数为______。(2)请写出酸性高锰酸钾溶液和二氧化硫反应的离子方程式,并标出电子转移的方向和数目__________________。解析:(1)①KMnO4溶液有强氧化性,会腐蚀橡胶,应盛放在酸式滴定管中;②KMnO4溶液本身有颜色,在草酸钠没有被消耗完之前,溶液是无色的,当草酸钠反应完后,溶液中因存在MnO而呈浅紫色;③由得失电子守恒原理得2n(Na2C2O4)=5n(KMnO4),n(Na2C2O4)=7。5×10-3mol,w(Na2C2O4)=7.5×10-3mol×134 g/mol÷1。34 g×100%=75%。(2)KMnO4与SO2反应时,SO2被氧化成SO,MnO被还原为Mn2+。能 力 提 升1.在一支25 mL的酸式滴定管中盛入0。1 mol·L-1的HCl溶液,其液面恰好在5 mL刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0。1 mol·L-1的NaOH溶液进行中和,则所需NaOH溶液的体积( A )A.大于20 mLB.小于20 mLC.等于20 mLD.等于5 mL解析:若要正确解答本题,必须准确了解滴定管的刻度特征,如图:滴定管下部有一段无刻度线,故从5 mL刻度到尖嘴底部的溶液体积大于20 mL,因此所需NaOH溶液的体积大于20 mL。2.(2019·安徽合肥一中高二月考)室温下,用0。1 mol/L NaOH溶液滴定0。1mol/L盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是( C )A.4B.7.2C.10D.11。3解析:c(OH-)==1×10-4mol/L,pH=10,故C项正确。3.某研究小组为测定食用白醋中醋酸的含量进行如下操作,正确的是( C )A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中B.称取4。0 g NaOH放到1 000 mL容量瓶中,加水至刻度,配成1。00 mol·L-1NaOH标准溶液C.用NaOH溶液滴定白醋,使用酚酞做指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点D.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量解析:量取白醋应用酸式滴定管,A错误;NaOH的溶解应在烧杯中完成,B错误;在滴定中操作时眼睛要注视锥形瓶内溶液颜色的变化.4.如图,曲线a和b是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是( B )A.盐酸的物质的量浓度为1 mol/LB.P点时反应恰好完全,溶液呈中性C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线D.酚酞不能用作本实验的指示剂解析:pH=1的盐酸对应的物质的量浓度为0。1 mol/L,A项错;盐酸和NaOH溶液完全反应时形成NaCl溶液,呈中性,B项正确;曲线a是用NaOH溶液滴定盐酸的曲线,b是用盐酸滴定NaOH溶液的曲线,通常用酚酞作指示剂,C、D两项错。5.以酚酞溶液为指示剂,对某新制的NaOH溶液进行中和滴定实验,数据记录如下表:该新制的NaOH溶液的浓度cmol·L-1合理的是( B )A.c=0。10×(V1+V2+V3)/(3×20)B.c=0。10×(V1+V2)/(2×20)C.c=0.10×(V1+V3)/(2×20)D.c=0。10V1/20解析:NaOH溶液中加10 mL水,溶质的量没变,消耗标准盐酸的体积不变,敞口隔夜放置的NaOH溶液,会变质生成Na2CO3,酚酞作指示剂时,Na2CO3与盐酸反应只能生成NaHCO3,消耗的盐酸偏少,所以V3不能用。6.中和滴定是一种操作简单,准确度高的定量分析方法。实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,下列有关几种具体的滴定分析(待测液置于锥形瓶内)的说法不正确的是( C )A.用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度:滴定终点时,溶液由无色变为紫红色B.利用“Ag++SCN-===AgSCN↓"反应,用标准KSCN溶液测量AgNO3溶液浓度时可用Fe(NO3)3作指示剂C.利用“2Fe3++2I-===I2+2Fe2+",用FeCl3溶液测量KI样品中KI的百分含量时,可用淀粉作指示剂D.用标准NaOH溶液测量某盐酸溶液的浓度时,若用酚酞作指示剂,当观察到溶液由无色变为红色,且半分钟不恢复时达到滴定终点解析:C中只要反应一开始就有I2生成,溶液就呈蓝色.7.用0。01 mol·L-1H2SO4滴定0。01 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定时终点判断有误差:①多加了1滴H2SO4②少加了1滴H2SO4(设1滴为0。05 mL).则①和②c(H+)之比是( C )A.10B.50C.104D.5×103解析:多加1滴则酸过量,c(H+)==1×10-5mol·L-1。少加1滴酸,OH-过量,其中c(OH-)也为1×10-5mol·L-1,则c(H+)==mol·L-1=10-9mol·L-1。所以两者比值为:10-5/10-9=104.8.Ⅰ.(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取______g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有______(用编号表示).①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管(2)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将______(填“偏大"“偏小”或“不变”).Ⅱ。称取1.840 g小苏打样品(含少量NaCl),配制成250 mL溶液,取出25。00 mL用0.100 0 mol/L盐酸滴定,消耗盐酸21.50 mL.实验中所需的定量仪器除滴定管外,还有______。选甲基橙而不选酚酞作为指示剂的原因是______。样品中NaHCO3质量分数为______。(保留3位小数)解析:Ⅰ。(1)m(K2Cr2O7)=0。010 00 mol·L-1×L×294.0 g·mol-1=0。735 0 g;配制该标准液需要用到天平、烧杯、量筒、玻璃棒、容量瓶、胶头滴管等仪器,不需要移液管,选⑦。(2)因气泡占有体积,使ΔV=V1-V2增大,结果偏大。Ⅱ.称取1.840 g小苏打样品需用定量仪器电子天平(不能用托盘天平),配制一定物质的量浓度的250 mL溶液,需要的定量仪器为250 mL的容量瓶.酚酞在pH.
已知酸性高锰酸钾溶液可以和草酸钠、二氧化硫等物质发生氧化还原反应.
(1)酸性高锰酸钾溶液和草酸钠反应的离子方程式为:MnO +C2O
+C2O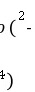 +H+→CO2↑+Mn2++H2O(未配平).现称取草酸钠(Na2C2O4)样品1.34 g溶于稀硫酸中,然后用0。20 mol·L-1的高锰酸钾溶液滴定(其中的杂质不跟高锰酸钾和稀硫酸反应),达到终点时消耗了15。00 mL的高锰酸钾溶液.
+H+→CO2↑+Mn2++H2O(未配平).现称取草酸钠(Na2C2O4)样品1.34 g溶于稀硫酸中,然后用0。20 mol·L-1的高锰酸钾溶液滴定(其中的杂质不跟高锰酸钾和稀硫酸反应),达到终点时消耗了15。00 mL的高锰酸钾溶液.
①KMnO4溶液应盛放在______(填“酸”或“碱”)式滴定管中。
②判断滴定达到终点时的现象是______。
③样品中草酸钠的质量分数为______。
(2)请写出酸性高锰酸钾溶液和二氧化硫反应的离子方程式,并标出电子转移的方向和数目
______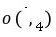 ______
______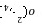 ______。
______。
解析:(1)①KMnO4溶液有强氧化性,会腐蚀橡胶,应盛放在酸式滴定管中;②KMnO4溶液本身有颜色,在草酸钠没有被消耗完之前,溶液是无色的,当草酸钠反应完后,溶液中因存在MnO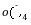 而呈浅紫色;③由得失电子守恒原理得2n(Na2C2O4)=5n(KMnO4),n(Na2C2O4)=7。5×10-3mol,w(Na2C2O4)=7.5×10-3mol×134 g/mol÷1。34 g×100%=75%。(2)KMnO4与SO2反应时,SO2被氧化成SO
而呈浅紫色;③由得失电子守恒原理得2n(Na2C2O4)=5n(KMnO4),n(Na2C2O4)=7。5×10-3mol,w(Na2C2O4)=7.5×10-3mol×134 g/mol÷1。34 g×100%=75%。(2)KMnO4与SO2反应时,SO2被氧化成SO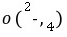 ,MnO
,MnO 被还原为Mn2+。
被还原为Mn2+。
 能 力 提 升
能 力 提 升
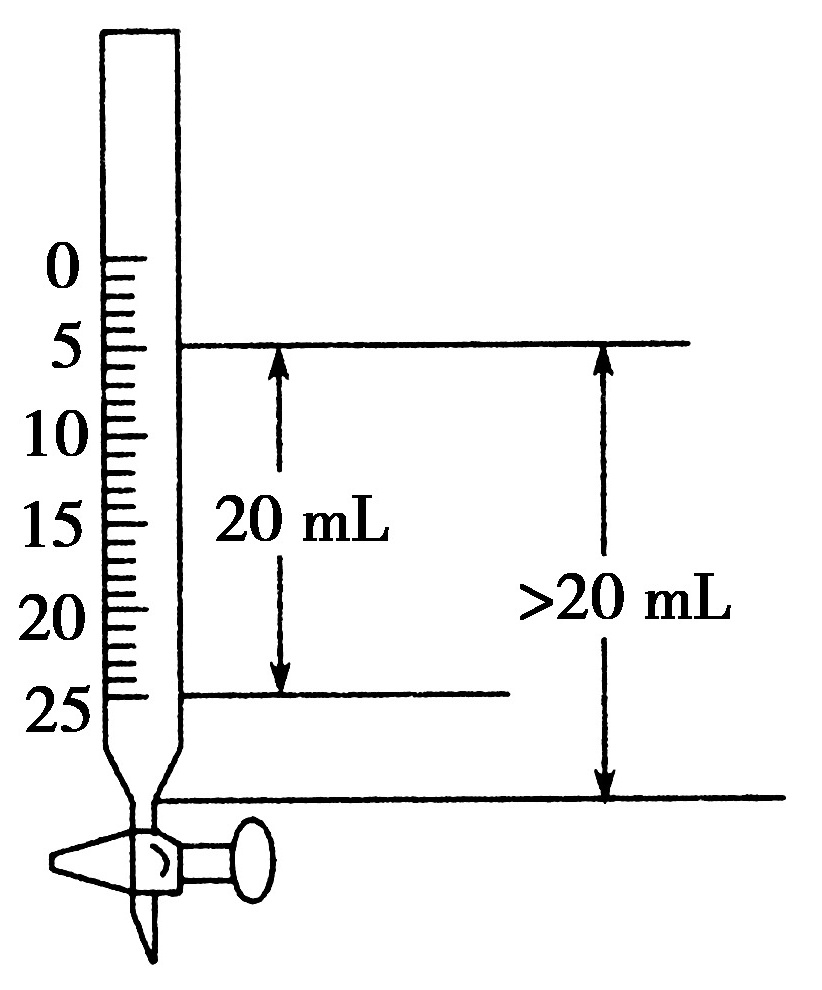
1.在一支25 mL的酸式滴定管中盛入0。1 mol·L-1的HCl溶液,其液面恰好在5 mL刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0。1 mol·L-1的NaOH溶液进行中和,则所需NaOH溶液的体积( A )
A.大于20 mLB.小于20 mL
C.等于20 mLD.等于5 mL
解析:若要正确解答本题,必须准确了解滴定管的刻度特征,如图:滴定管下部有一段无刻度线,故从5 mL刻度到尖嘴底部的溶液体积大于20 mL,因此所需NaOH溶液的体积大于20 mL。
2.(2019·安徽合肥一中高二月考)室温下,用0。1 mol/L NaOH溶液滴定0。1mol/L盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是( C )
A.4B.7.2
C.10D.11。3
解析:c(OH-)=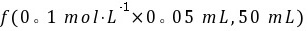 =1×10-4mol/L,pH=10,故C项正确。
=1×10-4mol/L,pH=10,故C项正确。
3.某研究小组为测定食用白醋中醋酸的含量进行如下操作,正确的是( C )
A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中
B.称取4。0 g NaOH放到1 000 mL容量瓶中,加水至刻度,配成1。00 mol·L-1NaOH标准溶液
C.用NaOH溶液滴定白醋,使用酚酞做指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点
D.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
解析:量取白醋应用酸式滴定管,A错误;NaOH的溶解应在烧杯中完成,B错误;在滴定中操作时眼睛要注视锥形瓶内溶液颜色的变化.
4.如图,曲线a和b是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是( B )
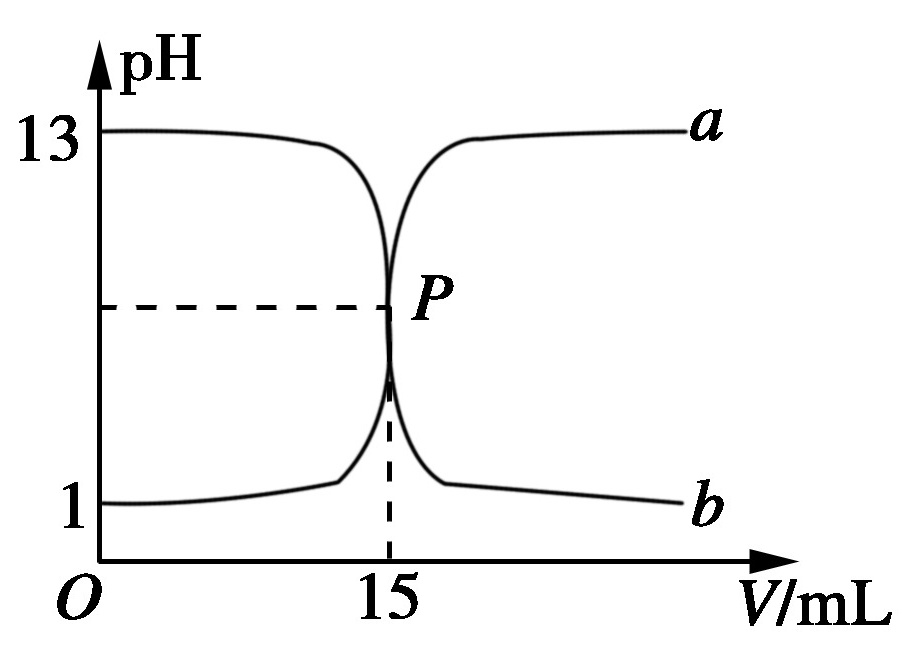
A.盐酸的物质的量浓度为1 mol/L
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
解析:pH=1的盐酸对应的物质的量浓度为0。1 mol/L,A项错;盐酸和NaOH溶液完全反应时形成NaCl溶液,呈中性,B项正确;曲线a是用NaOH溶液滴定盐酸的曲线,b是用盐酸滴定NaOH溶液的曲线,通常用酚酞作指示剂,C、D两项错。
5.以酚酞溶液为指示剂,对某新制的NaOH溶液进行中和滴定实验,数据记录如下表:
该新制的NaOH溶液的浓度cmol·L-1合理的是( B )
A.c=0。10×(V1+V2+V3)/(3×20)
B.c=0。10×(V1+V2)/(2×20)
C.c=0.10×(V1+V3)/(2×20)
D.c=0。10V1/20
解析:NaOH溶液中加10 mL水,溶质的量没变,消耗标准盐酸的体积不变,敞口隔夜放置的NaOH溶液,会变质生成Na2CO3,酚酞作指示剂时,Na2CO3与盐酸反应只能生成NaHCO3,消耗的盐酸偏少,所以V3不能用。
6.中和滴定是一种操作简单,准确度高的定量分析方法。实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,下列有关几种具体的滴定分析(待测液置于锥形瓶内)的说法不正确的是( C )
A.用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度:滴定终点时,溶液由无色变为紫红色
B.利用“Ag++SCN-===AgSCN↓"反应,用标准KSCN溶液测量AgNO3溶液浓度时可用Fe(NO3)3作指示剂
C.利用“2Fe3++2I-===I2+2Fe2+",用FeCl3溶液测量KI样品中KI的百分含量时,可用淀粉作指示剂
D.用标准NaOH溶液测量某盐酸溶液的浓度时,若用酚酞作指示剂,当观察到溶液由无色变为红色,且半分钟不恢复时达到滴定终点
解析:C中只要反应一开始就有I2生成,溶液就呈蓝色.
7.用0。01 mol·L-1H2SO4滴定0。01 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定时终点判断有误差:①多加了1滴H2SO4②少加了1滴H2SO4(设1滴为0。05 mL).则①和②c(H+)之比是( C )
A.10B.50
C.104D.5×103
解析:多加1滴则酸过量,c(H+)==1×10-5mol·L-1。少加1滴酸,OH-过量,其中c(OH-)也为1×10-5mol·L-1,则c(H+)==mol·L-1=10-9mol·L-1。所以两者比值为:10-5/10-9=104.
8.Ⅰ.(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取______g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有______(用编号表示).
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(2)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将______(填“偏大"“偏小”或“不变”).
Ⅱ。称取1.840 g小苏打样品(含少量NaCl),配制成250 mL溶液,取出25。00 mL用0.100 0 mol/L盐酸滴定,消耗盐酸21.50 mL.
实验中所需的定量仪器除滴定管外,还有______。
选甲基橙而不选酚酞作为指示剂的原因是______。
样品中NaHCO3质量分数为______。(保留3位小数)
解析:Ⅰ。(1)m(K2Cr2O7)=0。010 00 mol·L-1×L×294.0 g·mol-1=0。735 0 g;配制该标准液需要用到天平、烧杯、量筒、玻璃棒、容量瓶、胶头滴管等仪器,不需要移液管,选⑦。(2)因气泡占有体积,使ΔV=V1-V2增大,结果偏大。
Ⅱ.称取1.840 g小苏打样品需用定量仪器电子天平(不能用托盘天平),配制一定物质的量浓度的250 mL溶液,需要的定量仪器为250 mL的容量瓶.酚酞在pH.
题目解答
答案
解析:若要正确解答本题,必须准确了解滴定管的刻度特征,如图:滴定管下部有一段无刻度线,故从5 mL刻度到尖嘴底部的溶液体积大于20 mL,因此所需NaOH溶液的体积大于20 mL。

2.(2019·安徽合肥一中高二月考)室温下,用0。1 mol/L NaOH溶液滴定0。1mol/L盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是( C )
A.4B.7.2
C.10D.11。3
.