题目
8-|||-9-|||-代表一个CO2分子苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.请回答下列问题:(1)组成上述物质的H、C、N、O四种元素中,基态氧原子的电子排布式是 ____ ;用轨道表示式表示基态碳原子外围电子排布 ____ .(2)下列叙述不正确的是 ____ .A.氮、氧两种元素基态原子的核外电子排布中电子占据的原子轨道相同B.元素第一电离能:H<C<N<OC.元素的电负性:H<C<N<OD.甲苯溶于苯,苯胺晶体溶于苯都只与范德华力有关(3)下列物质中,只含有极性键的分子是 ____ ,同时存在σ键和π键的分子是 ____ .A.N2 B.CH4 C.C6H6 D.C6H5OHE.C6H5ONa F.CO2 G.C6H5NH3Cl(4)晶体苯的晶胞结构与干冰相似(图为干冰晶胞结构模型).晶体苯晶胞边长为a cm,每个晶胞中含有 ____ 个苯分子,晶体苯密度是 ____ g•cm-3.(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)
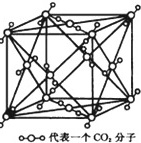 苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.
苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.请回答下列问题:
(1)组成上述物质的H、C、N、O四种元素中,基态氧原子的电子排布式是 ____ ;用轨道表示式表示基态碳原子外围电子排布 ____ .
(2)下列叙述不正确的是 ____ .
A.氮、氧两种元素基态原子的核外电子排布中电子占据的原子轨道相同
B.元素第一电离能:H<C<N<O
C.元素的电负性:H<C<N<O
D.甲苯溶于苯,苯胺晶体溶于苯都只与范德华力有关
(3)下列物质中,只含有极性键的分子是 ____ ,同时存在σ键和π键的分子是 ____ .
A.N2 B.CH4 C.C6H6 D.C6H5OHE.C6H5ONa F.CO2 G.C6H5NH3Cl
(4)晶体苯的晶胞结构与干冰相似(图为干冰晶胞结构模型).晶体苯晶胞边长为a cm,每个晶胞中含有 ____ 个苯分子,晶体苯密度是 ____ g•cm-3.(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)
题目解答
答案
解:(1)氧是8号元素,根据核外电子排布规律可知基态氧原子的电子排布式为1s22s22p4,碳是6号元素,外围有4个电子,基态碳原子外围电子排布为2s22p2,
故答案为:1s22s22p4;2s22p2;
(2)A.氮的基态原子的核外电子排布为1s22s22p3,氧元素基态原子的核外电子排布为1s22s22p4,故A正确;
B.氮原子核外最外层是半满结构,是一种稳定结构,所以元素第一电离能:N>O,故B错误;
C.元素的非金属性越强,元素的电负性越大,所以电负性:H<C<N<O,故C正确;
D.苯胺晶体溶于苯不公与范德华力有关,还与氢键有关,故D错误,
故选BD;
(3)不同原子之间形成的供价键是极性键,同种原子之间形成非极性键,所以CH4、CO2只有极性键,故选BF,双键或参键中含有σ键和π键,所以同时存在σ键和π键的分子是N2、C6H6、C6H5OH、CO2、C6H5NH3Cl,故选ACDF,
故答案为:BF;ACDF;
(4)根据均摊法,晶体中含有苯分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据$ρ=\frac{m}{V}$可知,晶胞的密度为$\frac{\frac{4×78}{{N}_{A}}}{{a}^{3}}$g•cm-3=$\frac{4×78}{{N}_{A}{a}^{3}}$g•cm-3,
故答案为:4;$\frac{4×78}{{N}_{A}{a}^{3}}$.
故答案为:1s22s22p4;2s22p2;
(2)A.氮的基态原子的核外电子排布为1s22s22p3,氧元素基态原子的核外电子排布为1s22s22p4,故A正确;
B.氮原子核外最外层是半满结构,是一种稳定结构,所以元素第一电离能:N>O,故B错误;
C.元素的非金属性越强,元素的电负性越大,所以电负性:H<C<N<O,故C正确;
D.苯胺晶体溶于苯不公与范德华力有关,还与氢键有关,故D错误,
故选BD;
(3)不同原子之间形成的供价键是极性键,同种原子之间形成非极性键,所以CH4、CO2只有极性键,故选BF,双键或参键中含有σ键和π键,所以同时存在σ键和π键的分子是N2、C6H6、C6H5OH、CO2、C6H5NH3Cl,故选ACDF,
故答案为:BF;ACDF;
(4)根据均摊法,晶体中含有苯分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据$ρ=\frac{m}{V}$可知,晶胞的密度为$\frac{\frac{4×78}{{N}_{A}}}{{a}^{3}}$g•cm-3=$\frac{4×78}{{N}_{A}{a}^{3}}$g•cm-3,
故答案为:4;$\frac{4×78}{{N}_{A}{a}^{3}}$.
解析
步骤 1:基态氧原子的电子排布
氧原子的原子序数为8,根据电子排布规则,其电子排布式为1s^{2}2s^{2}2p^{4}。
步骤 2:基态碳原子的外围电子排布
碳原子的原子序数为6,外围电子排布为2s^{2}2p^{2},用轨道表示式表示为:$\uparrow\downarrow$ $\uparrow$ $\uparrow$。
步骤 3:判断元素的电离能和电负性
氮原子的最外层电子排布为2s^{2}2p^{3},由于2p轨道为半满状态,因此氮的电离能高于氧。电负性顺序为H<C<N<O。
步骤 4:判断分子中的化学键类型
CH_4和CO_2只含有极性键,N_2、C_6H_6、C_6H_5OH、CO_2、C_6H_5NH_3Cl同时存在σ键和π键。
步骤 5:计算晶体苯的晶胞中苯分子数和密度
根据均摊法,晶体中含有苯分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,晶胞的密度为$\frac{\frac{4×78}{{N}_{A}}}{{a}^{3}}$g•cm^{-3}=$\frac{4×78}{{N}_{A}{a}^{3}}$g•cm^{-3}。
氧原子的原子序数为8,根据电子排布规则,其电子排布式为1s^{2}2s^{2}2p^{4}。
步骤 2:基态碳原子的外围电子排布
碳原子的原子序数为6,外围电子排布为2s^{2}2p^{2},用轨道表示式表示为:$\uparrow\downarrow$ $\uparrow$ $\uparrow$。
步骤 3:判断元素的电离能和电负性
氮原子的最外层电子排布为2s^{2}2p^{3},由于2p轨道为半满状态,因此氮的电离能高于氧。电负性顺序为H<C<N<O。
步骤 4:判断分子中的化学键类型
CH_4和CO_2只含有极性键,N_2、C_6H_6、C_6H_5OH、CO_2、C_6H_5NH_3Cl同时存在σ键和π键。
步骤 5:计算晶体苯的晶胞中苯分子数和密度
根据均摊法,晶体中含有苯分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,晶胞的密度为$\frac{\frac{4×78}{{N}_{A}}}{{a}^{3}}$g•cm^{-3}=$\frac{4×78}{{N}_{A}{a}^{3}}$g•cm^{-3}。