题目
[例6.6]已知N2(g)+3H2(g )=2NH3(g) △H^θ=-91.8kJ·mol^(-1),298K时-|||-_({P)_(1)}(298K)=5.8times (10)^5 。求合成氨反应在473 K、673K的平衡常数。

题目解答
答案
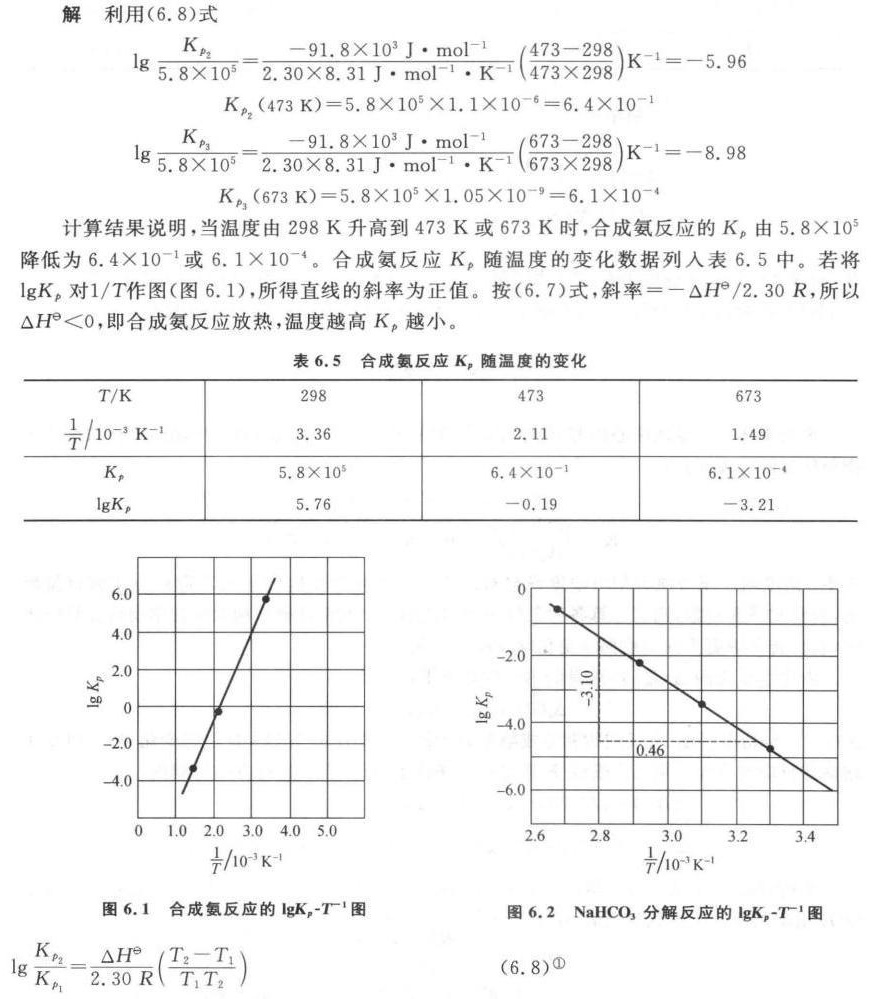
解析
步骤 1:确定平衡常数与温度的关系
根据范特霍夫方程,平衡常数 $K_p$ 与温度 $T$ 的关系可以表示为:
$$\ln \frac{K_{p2}}{K_{p1}} = -\frac{\Delta H^\theta}{R} \left(\frac{1}{T_2} - \frac{1}{T_1}\right)$$
其中,$\Delta H^\theta$ 是反应的焓变,$R$ 是理想气体常数,$T_1$ 和 $T_2$ 分别是两个不同温度下的温度值,$K_{p1}$ 和 $K_{p2}$ 分别是这两个温度下的平衡常数。
步骤 2:计算473 K时的平衡常数
将已知数据代入范特霍夫方程,计算473 K时的平衡常数 $K_{p2}$。
$$\ln \frac{K_{p2}}{5.8 \times 10^5} = -\frac{-91.8 \times 10^3}{8.314} \left(\frac{1}{473} - \frac{1}{298}\right)$$
$$\ln \frac{K_{p2}}{5.8 \times 10^5} = 1.1 \times 10^{-6}$$
$$K_{p2} = 5.8 \times 10^5 \times 1.1 \times 10^{-6} = 6.4 \times 10^{-1}$$
步骤 3:计算673 K时的平衡常数
同样地,将已知数据代入范特霍夫方程,计算673 K时的平衡常数 $K_{p2}$。
$$\ln \frac{K_{p2}}{5.8 \times 10^5} = -\frac{-91.8 \times 10^3}{8.314} \left(\frac{1}{673} - \frac{1}{298}\right)$$
$$\ln \frac{K_{p2}}{5.8 \times 10^5} = 1.05 \times 10^{-9}$$
$$K_{p2} = 5.8 \times 10^5 \times 1.05 \times 10^{-9} = 6.1 \times 10^{-4}$$
根据范特霍夫方程,平衡常数 $K_p$ 与温度 $T$ 的关系可以表示为:
$$\ln \frac{K_{p2}}{K_{p1}} = -\frac{\Delta H^\theta}{R} \left(\frac{1}{T_2} - \frac{1}{T_1}\right)$$
其中,$\Delta H^\theta$ 是反应的焓变,$R$ 是理想气体常数,$T_1$ 和 $T_2$ 分别是两个不同温度下的温度值,$K_{p1}$ 和 $K_{p2}$ 分别是这两个温度下的平衡常数。
步骤 2:计算473 K时的平衡常数
将已知数据代入范特霍夫方程,计算473 K时的平衡常数 $K_{p2}$。
$$\ln \frac{K_{p2}}{5.8 \times 10^5} = -\frac{-91.8 \times 10^3}{8.314} \left(\frac{1}{473} - \frac{1}{298}\right)$$
$$\ln \frac{K_{p2}}{5.8 \times 10^5} = 1.1 \times 10^{-6}$$
$$K_{p2} = 5.8 \times 10^5 \times 1.1 \times 10^{-6} = 6.4 \times 10^{-1}$$
步骤 3:计算673 K时的平衡常数
同样地,将已知数据代入范特霍夫方程,计算673 K时的平衡常数 $K_{p2}$。
$$\ln \frac{K_{p2}}{5.8 \times 10^5} = -\frac{-91.8 \times 10^3}{8.314} \left(\frac{1}{673} - \frac{1}{298}\right)$$
$$\ln \frac{K_{p2}}{5.8 \times 10^5} = 1.05 \times 10^{-9}$$
$$K_{p2} = 5.8 \times 10^5 \times 1.05 \times 10^{-9} = 6.1 \times 10^{-4}$$