题目
用pNa电极和SCE组成的测量电池 pNa电极|Na+(a=x)||SCE 在25℃时,用标准Na+溶液(pNa=4.00),测得电动势为0.209V,用于未知液时,电动势 为0.091V,求它的pNa值。
用pNa电极和SCE组成的测量电池 pNa电极|Na+(a=x)||SCE 在25℃时,用标准Na+溶液(pNa=4.00),测得电动势为0.209V,用于未知液时,电动势 为0.091V,求它的pNa值。
题目解答
答案
解: E电池=K-RT/nFlnaNa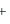 =K+0.059pNa
=K+0.059pNa
0.209=K+0.059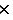 4.00
4.00
0.091=K+0.059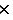 pNa
pNa  pNa=2.00
pNa=2.00
解析
步骤 1:确定电池电动势与pNa的关系
根据能斯特方程,电池电动势E与溶液中Na+的活度aNa的关系为:
\[ E = K - \frac{RT}{nF} \ln a_{Na} \]
其中,K为常数,R为气体常数,T为温度,n为电子转移数,F为法拉第常数。在25℃时,可以简化为:
\[ E = K + 0.059 \cdot pNa \]
步骤 2:利用标准溶液确定常数K
已知标准Na+溶液的pNa=4.00,测得电动势为0.209V,代入上述方程求解K:
\[ 0.209 = K + 0.059 \cdot 4.00 \]
\[ K = 0.209 - 0.059 \cdot 4.00 \]
\[ K = 0.209 - 0.236 \]
\[ K = -0.027 \]
步骤 3:利用未知液的电动势求解pNa
已知未知液的电动势为0.091V,代入上述方程求解pNa:
\[ 0.091 = -0.027 + 0.059 \cdot pNa \]
\[ 0.059 \cdot pNa = 0.091 + 0.027 \]
\[ 0.059 \cdot pNa = 0.118 \]
\[ pNa = \frac{0.118}{0.059} \]
\[ pNa = 2.00 \]
根据能斯特方程,电池电动势E与溶液中Na+的活度aNa的关系为:
\[ E = K - \frac{RT}{nF} \ln a_{Na} \]
其中,K为常数,R为气体常数,T为温度,n为电子转移数,F为法拉第常数。在25℃时,可以简化为:
\[ E = K + 0.059 \cdot pNa \]
步骤 2:利用标准溶液确定常数K
已知标准Na+溶液的pNa=4.00,测得电动势为0.209V,代入上述方程求解K:
\[ 0.209 = K + 0.059 \cdot 4.00 \]
\[ K = 0.209 - 0.059 \cdot 4.00 \]
\[ K = 0.209 - 0.236 \]
\[ K = -0.027 \]
步骤 3:利用未知液的电动势求解pNa
已知未知液的电动势为0.091V,代入上述方程求解pNa:
\[ 0.091 = -0.027 + 0.059 \cdot pNa \]
\[ 0.059 \cdot pNa = 0.091 + 0.027 \]
\[ 0.059 \cdot pNa = 0.118 \]
\[ pNa = \frac{0.118}{0.059} \]
\[ pNa = 2.00 \]