题目
两个相连的容器,一个体积为11dm^3,内装氮气,压力为 https:/img.zuoyebang.cc/zyb_6bd22e06a883aa9fa3c8c79f51699bcd.jpg.6times (10)^5Ncdot (m)^-2; 另一个体-|||-积为44dm^3,内装氧气,压力为 .6times (10)^5Ncdot (m)^-2 当打开连通旋塞后,两种气体充分均匀地混-|||-合。试计算:(1)混合气体的总压;(2)每种气体的分压和摩尔分数。

题目解答
答案
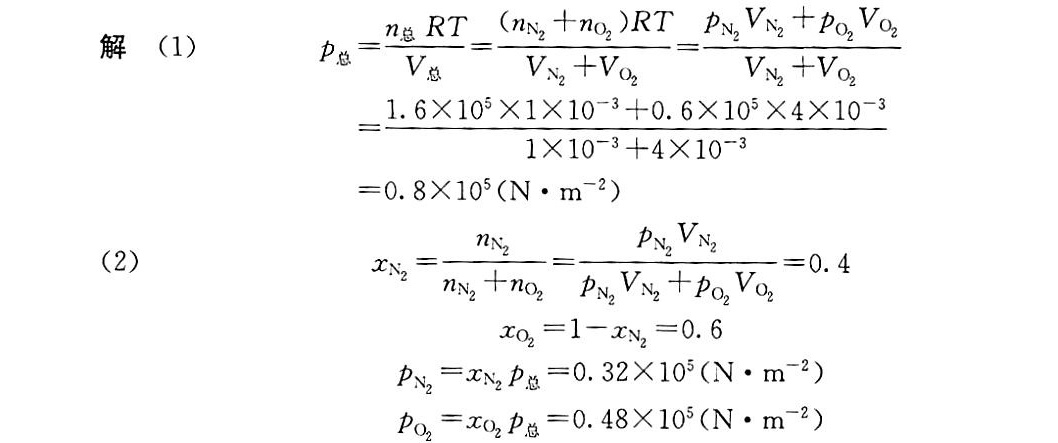
解析
本题考查理想气体状态方程和道尔顿分压定律的应用。关键在于理解两种气体混合后,总压为各气体分压之和,而分压与气体的物质的量比例相关。解题时需注意单位换算(体积从dm³转换为m³),并正确应用分压公式。
第(1)题:混合气体的总压
应用理想气体状态方程
混合前后温度不变,总压可通过以下公式计算:
$P_{\text{总}} = \frac{P_1 V_1 + P_2 V_2}{V_1 + V_2}$
代入数据
- 氮气体积 $V_1 = 11 \, \text{dm}^3 = 0.011 \, \text{m}^3$,压力 $P_1 = 1.6 \times 10^5 \, \text{N·m}^{-2}$
- 氧气体积 $V_2 = 44 \, \text{dm}^3 = 0.044 \, \text{m}^3$,压力 $P_2 = 0.6 \times 10^5 \, \text{N·m}^{-2}$
- 总体积 $V_{\text{总}} = 0.011 + 0.044 = 0.055 \, \text{m}^3$
计算分子:
$P_1 V_1 = 1.6 \times 10^5 \times 0.011 = 1760 \, \text{N·m}, \quad P_2 V_2 = 0.6 \times 10^5 \times 0.044 = 2640 \, \text{N·m}$
总压:
$P_{\text{总}} = \frac{1760 + 2640}{0.055} = \frac{4400}{0.055} = 8 \times 10^4 \, \text{N·m}^{-2}$
第(2)题:分压和摩尔分数
氮气的分压
$P_{N_2} = \frac{P_1 V_1}{V_{\text{总}}} = \frac{1.6 \times 10^5 \times 0.011}{0.055} = 3.2 \times 10^4 \, \text{N·m}^{-2}$
氧气的分压
$P_{O_2} = \frac{P_2 V_2}{V_{\text{总}}} = \frac{0.6 \times 10^5 \times 0.044}{0.055} = 4.8 \times 10^4 \, \text{N·m}^{-2}$
摩尔分数
- 氮气摩尔分数:
$x_{N_2} = \frac{P_{N_2}}{P_{\text{总}}} = \frac{3.2 \times 10^4}{8 \times 10^4} = 0.4$ - 氧气摩尔分数:
$x_{O_2} = 1 - x_{N_2} = 0.6$