(14分)(2014秋•北仑区校级期中)钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.(1)铁在潮湿的空气中容易被腐蚀,写出铁发生电化学腐蚀时负极的电极反应:Fe﹣2e﹣=Fe2+.(2)如图1是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.①该腐蚀属于吸氧腐蚀(填“析氢腐蚀”或“吸氧腐蚀”).②如图中A、B、C、D四个区域,生成铁锈最多的是B(填字母).(3)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被完全除尽后,溶液中继续发生的化合反应的离子方程式为2Fe3++Fe═3Fe2+(4)下列各个装置中铁棒被腐蚀由难到易的顺序是DBCA(填字母).A-|||-AB = 海水-|||-=二:二:-|||-二:二:二 磷 得 评 词 A B-|||-最-|||-重的 磷-|||-= 区域 木 5.∵ 水 下 CuSO 4溶液-|||-= A ? c-|||-图1 图2 图3(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图:请回答:①B电极对应的金属是Fe,A电极的电极反应式是Cu﹣2e﹣=Cu2+②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
(14分)(2014秋•北仑区校级期中)钢铁工业是国家工业的基础.请回答钢铁腐蚀、防护过程中的有关问题.
(1)铁在潮湿的空气中容易被腐蚀,写出铁发生电化学腐蚀时负极的电极反应:Fe﹣2e﹣=Fe2+.
(2)如图1是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.
①该腐蚀属于吸氧腐蚀(填“析氢腐蚀”或“吸氧腐蚀”).
②如图中A、B、C、D四个区域,生成铁锈最多的是B(填字母).
(3)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被完全除尽后,溶液中继续发生的化合反应的离子方程式为2Fe3++Fe═3Fe2+
(4)下列各个装置中铁棒被腐蚀由难到易的顺序是DBCA(填字母).
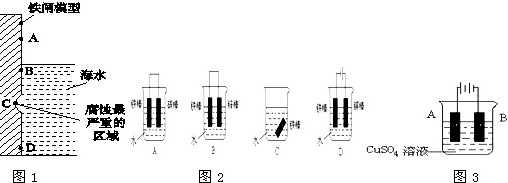
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图:请回答:
①B电极对应的金属是Fe,A电极的电极反应式是Cu﹣2e﹣=Cu2+
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
题目解答
答案
26考点: 金属的电化学腐蚀与防护.
分析: (1)铁发生电化学腐蚀时,负极上Fe失电子发生氧化反应生成亚铁离子;
(2)中性或弱酸性条件下,铁发生吸氧腐蚀,铁接触空气、水时腐蚀最严重;
(3)铁锈和HCl反应生成铁离子,铁离子和Fe发生氧化还原反应生成亚铁离子;
(4)作原电池负极或电解池阳极的金属加速被腐蚀,作原电池正极或电解池阴极的金属被保护;
(5)①电镀时,镀层作阳极、镀件作阴极,阳极上金属材料失电子发生氧化反应;
②作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护.
解答: 解:(1)铁发生电化学腐蚀时,负极上Fe失电子发生氧化反应生成亚铁离子,电极反应式为Fe﹣2e﹣=Fe2+,故答案为:Fe﹣2e﹣=Fe2+;
(2)海水溶液呈中性,则钢铁发生吸氧腐蚀,钢铁接触空气、水时腐蚀最严重,所以B处腐蚀最严重,
故答案为:吸氧腐蚀;B;
(3)铁锈和HCl反应生成铁离子,铁离子和Fe发生氧化还原反应生成亚铁离子,离子方程式为2 Fe3++Fe═3 Fe2+,故答案为:2 Fe3++Fe═3 Fe2+;
(4)在金属腐蚀中,腐蚀快慢顺序是做电解池阳极>作原电池负极>化学腐蚀>作原电池正极>作电解池阴极,根据图象知,A中Fe作负极、B中铁作正极、C中铁发生化学腐蚀、D中铁作阴极,所以铁腐蚀快慢顺序是D BCA,故答案为:D BCA;
(5)①电镀时,镀层Cu作阳极、镀件Fe作阴极,所以B的材料是Fe,阳极电极反应式为Cu﹣2e﹣=Cu2+,故答案为:铁;Cu﹣2e﹣=Cu2+;
②Fe、Cu和电解质溶液构成原电池时,铁易失电子作负极加速被腐蚀,Zn、Fe和电解质溶液构成原电池,Zn易失电子作负极,Fe作正极被保护,所以铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀,
故答案为:铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
点评: 本题考查金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道金属腐蚀快慢顺序、钢铁发生析氢腐蚀和吸氧腐蚀条件,题目难度不大.