题目
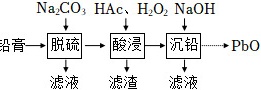
废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。Na2CO3HAc、H 2O2 NaOH-|||-铅膏 → 脱硫 酸浸 沉铅 PbO-|||-滤液 滤渣 滤液一些难溶电解质的溶度积常数如下表: 难溶电解质 PbSO4 PbCO3 BaSO4 BaCO3 Ksp 2.5×10-8 7.4×10-14 1.1×10-10 2.6×10-9 一定条件下,一些金属氢氧化物沉淀时的pH如下表: 金属氢氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Pb(OH)2 开始沉淀的pH 2.3 6.8 3.5 7.2 完全沉淀的pH 3.2 8.3 4.6 9.1 回答下列问题:(1)在“脱硫”中PbSO4转化反应的离子方程式为 ____ ,用沉淀溶解平衡原理解释选择Na2CO3的原因 ____ 。(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,原因是 ____ 。(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。(ⅰ)能被H2O2氧化的离子是 ____ ;(ⅱ)H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为 ____ ;(ⅲ)H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是 ____ 。(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是 ____ 。(5)“沉铅”的滤液中,金属离子有 ____ 。
废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)在“脱硫”中PbSO4转化反应的离子方程式为 ____ ,用沉淀溶解平衡原理解释选择Na2CO3的原因 ____ 。
(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,原因是 ____ 。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。
(ⅰ)能被H2O2氧化的离子是 ____ ;
(ⅱ)H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为 ____ ;
(ⅲ)H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是 ____ 。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是 ____ 。
(5)“沉铅”的滤液中,金属离子有 ____ 。

一些难溶电解质的溶度积常数如下表:
| 难溶电解质 | PbSO4 | PbCO3 | BaSO4 | BaCO3 |
| Ksp | 2.5×10-8 | 7.4×10-14 | 1.1×10-10 | 2.6×10-9 |
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Pb(OH)2 |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中PbSO4转化反应的离子方程式为 ____ ,用沉淀溶解平衡原理解释选择Na2CO3的原因 ____ 。
(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,原因是 ____ 。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。
(ⅰ)能被H2O2氧化的离子是 ____ ;
(ⅱ)H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为 ____ ;
(ⅲ)H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是 ____ 。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是 ____ 。
(5)“沉铅”的滤液中,金属离子有 ____ 。
题目解答
答案
解:(1)“脱硫”中,碳酸钠溶液与硫酸铅反应生成碳酸铅和硫酸钠,反应的离子方程式为:PbSO4(s)+CO32-(aq)⇌PbCO3(s)+SO42-(aq),由一些难溶电解质的溶度积常数的数据可知,Ksp(PbCO3)=7.4×10-14,Ksp(PbSO4)=2.5×10-8,反应PbSO4(s)+CO32-(aq)⇌PbCO3(s)+SO42-(aq)的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{c(P{b}^{2+})×c(S{O}_{4}^{2-})}{c(P{b}^{2+})×c(C{O}_{3}^{2-})}$=$\frac{{K}_{sp}(PbS{O}_{4})}{{K}_{sp}(PbC{O}_{3})}$=$\frac{2.5×1{0}^{-8}}{7.4×1{0}^{-14}}$≈3.4×105>105,说明可以转化的比较彻底,且转化后生成的碳酸铅可由酸浸进入溶液中,减少铅的损失,
故答案为:PbSO4(s)+CO32-(aq)⇌PbCO3(s)+SO42-(aq);反应PbSO4(s)+CO32-(aq)⇌PbCO3(s)+SO42-(aq)的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{c(P{b}^{2+})×c(S{O}_{4}^{2-})}{c(P{b}^{2+})×c(C{O}_{3}^{2-})}$=$\frac{{K}_{sp}(PbS{O}_{4})}{{K}_{sp}(PbC{O}_{3})}$=$\frac{2.5×1{0}^{-8}}{7.4×1{0}^{-14}}$≈3.4×105>105,说明PbSO4可以比较彻底的转化为PbCO3;
(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,主要原因是反应BaSO4(s)+CO32-(aq)⇌BaCO3(s)+SO42-(aq)的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{c(P{b}^{2+})×c(S{O}_{4}^{2-})}{c(P{b}^{2+})×c(C{O}_{3}^{2-})}$=$\frac{{K}_{sp}(PbS{O}_{4})}{{K}_{sp}(PbC{O}_{3})}$=$\frac{1.1×1{0}^{-10}}{2.6×1{0}^{-9}}$≈0.04<<105,说明该反应正向进行的程度有限,因此加入碳酸钠不能使铅膏中的BaSO4完全转化,
故答案为:反应BaSO4(s)+CO32-(aq)⇌BaCO3(s)+SO42-(aq)的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{c(P{b}^{2+})×c(S{O}_{4}^{2-})}{c(P{b}^{2+})×c(C{O}_{3}^{2-})}$=$\frac{{K}_{sp}(PbS{O}_{4})}{{K}_{sp}(PbC{O}_{3})}$=$\frac{1.1×1{0}^{-10}}{2.6×1{0}^{-9}}$≈0.04<<105,说明该反应正向进行的程度有限,因此加入碳酸钠不能使铅膏中的BaSO4完全转化;
(3)(i)过氧化氢有氧化性,亚铁离子有还原性,会被过氧化氢氧化为铁离子,
故答案为:Fe2+;
(ii)过氧化氢促进金属Pb在醋酸溶液中转化为Pb(Ac)2,过氧化氢与Pb、HAc发生氧还原反应生成Pb(Ac)2和H2O,依据得失电子守恒和原子守恒可知,反应的化学方程式为:Pb+H2O2+2HAc=Pb(Ac)2+2H2O,
故答案为:Pb+H2O2+2HAc=Pb(Ac)2+2H2O;
(iii)过氧化氢也能使PbO2转化为Pb(Ac)2,铅元素化合价由+4价降低到了+2价,PbO2是氧化剂,则过氧化氢是还原剂,
故答案为:作还原剂;
(4)酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁,
故答案为:Fe(OH)3、Al(OH)3;
(5)依据分析可知,加入碳酸钠不能使铅膏中的BaSO4完全转化,铁离子、铝离子转化为了氢氧化铁、氢氧化铝沉淀,铅转化为了氢氧化铅、最终变为了氧化铅,因此沉铅的滤液中,金属离子有Ba2+和加入碳酸钠、氢氧化钠时引入的Na+,
故答案为:Ba2+、Na+。
故答案为:PbSO4(s)+CO32-(aq)⇌PbCO3(s)+SO42-(aq);反应PbSO4(s)+CO32-(aq)⇌PbCO3(s)+SO42-(aq)的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{c(P{b}^{2+})×c(S{O}_{4}^{2-})}{c(P{b}^{2+})×c(C{O}_{3}^{2-})}$=$\frac{{K}_{sp}(PbS{O}_{4})}{{K}_{sp}(PbC{O}_{3})}$=$\frac{2.5×1{0}^{-8}}{7.4×1{0}^{-14}}$≈3.4×105>105,说明PbSO4可以比较彻底的转化为PbCO3;
(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,主要原因是反应BaSO4(s)+CO32-(aq)⇌BaCO3(s)+SO42-(aq)的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{c(P{b}^{2+})×c(S{O}_{4}^{2-})}{c(P{b}^{2+})×c(C{O}_{3}^{2-})}$=$\frac{{K}_{sp}(PbS{O}_{4})}{{K}_{sp}(PbC{O}_{3})}$=$\frac{1.1×1{0}^{-10}}{2.6×1{0}^{-9}}$≈0.04<<105,说明该反应正向进行的程度有限,因此加入碳酸钠不能使铅膏中的BaSO4完全转化,
故答案为:反应BaSO4(s)+CO32-(aq)⇌BaCO3(s)+SO42-(aq)的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{c(P{b}^{2+})×c(S{O}_{4}^{2-})}{c(P{b}^{2+})×c(C{O}_{3}^{2-})}$=$\frac{{K}_{sp}(PbS{O}_{4})}{{K}_{sp}(PbC{O}_{3})}$=$\frac{1.1×1{0}^{-10}}{2.6×1{0}^{-9}}$≈0.04<<105,说明该反应正向进行的程度有限,因此加入碳酸钠不能使铅膏中的BaSO4完全转化;
(3)(i)过氧化氢有氧化性,亚铁离子有还原性,会被过氧化氢氧化为铁离子,
故答案为:Fe2+;
(ii)过氧化氢促进金属Pb在醋酸溶液中转化为Pb(Ac)2,过氧化氢与Pb、HAc发生氧还原反应生成Pb(Ac)2和H2O,依据得失电子守恒和原子守恒可知,反应的化学方程式为:Pb+H2O2+2HAc=Pb(Ac)2+2H2O,
故答案为:Pb+H2O2+2HAc=Pb(Ac)2+2H2O;
(iii)过氧化氢也能使PbO2转化为Pb(Ac)2,铅元素化合价由+4价降低到了+2价,PbO2是氧化剂,则过氧化氢是还原剂,
故答案为:作还原剂;
(4)酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁,
故答案为:Fe(OH)3、Al(OH)3;
(5)依据分析可知,加入碳酸钠不能使铅膏中的BaSO4完全转化,铁离子、铝离子转化为了氢氧化铁、氢氧化铝沉淀,铅转化为了氢氧化铅、最终变为了氧化铅,因此沉铅的滤液中,金属离子有Ba2+和加入碳酸钠、氢氧化钠时引入的Na+,
故答案为:Ba2+、Na+。