298.15K时,反应(H)_(2)(O)_(2) (l) leftharpoons 2(H)_(2) O (l) +(O)_(2)(g)的(H)_(2)(O)_(2) (l) leftharpoons 2(H)_(2) O (l) +(O)_(2)(g),(H)_(2)(O)_(2) (l) leftharpoons 2(H)_(2) O (l) +(O)_(2)(g)。试分别计算该反应在298.15K和373.15K的(H)_(2)(O)_(2) (l) leftharpoons 2(H)_(2) O (l) +(O)_(2)(g)值。
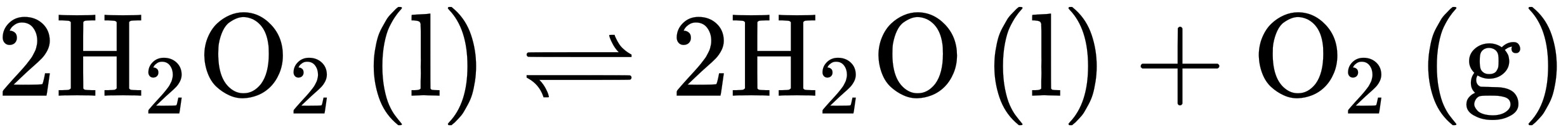 的
的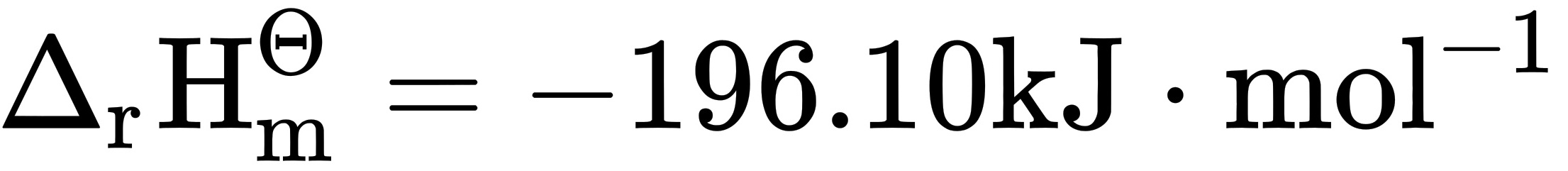 ,
, 。试分别计算该反应在298.15K和373.15K的
。试分别计算该反应在298.15K和373.15K的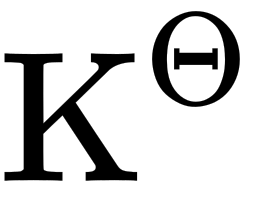 值。
值。题目解答
答案

解析
考查要点:本题主要考查化学反应的吉布斯自由能变化与平衡常数的关系,以及温度对平衡常数的影响。
解题核心思路:
- 利用ΔG°与ΔH°、ΔS°的关系:通过公式 $\Delta G^\theta = \Delta H^\theta - T\Delta S^\theta$ 计算不同温度下的标准吉布斯自由能变化。
- 联结ΔG°与平衡常数K:通过公式 $\Delta G^\theta = -RT\ln K$,将ΔG°转换为平衡常数K。
- 注意单位统一:ΔH的单位为kJ/mol,ΔS的单位为J/mol·K,需统一单位后再代入计算。
破题关键点:
- 单位转换:将ΔS的单位从J/mol·K转换为kJ/mol·K,确保计算过程中单位一致。
- 温度对ΔG的影响:温度升高时,ΔG的变化趋势由ΔS的符号决定,进而影响平衡常数K的大小。
步骤1:计算ΔG°
根据公式 $\Delta G^\theta = \Delta H^\theta - T\Delta S^\theta$,需先统一单位:
- $\Delta H^\theta = -196.10 \, \text{kJ/mol}$(无需转换)
- $\Delta S^\theta = 125.76 \, \text{J/mol·K} = 0.12576 \, \text{kJ/mol·K}$
298.15K时:
$\Delta G^\theta = -196.10 - 298.15 \times 0.12576 = -196.10 - 37.53 = -233.63 \, \text{kJ/mol}$
373.15K时:
$\Delta G^\theta = -196.10 - 373.15 \times 0.12576 = -196.10 - 46.95 = -243.05 \, \text{kJ/mol}$
步骤2:计算平衡常数K
通过公式 $\Delta G^\theta = -RT\ln K$,变形得:
$\ln K = -\frac{\Delta G^\theta}{RT}$
其中 $R = 8.314 \, \text{J/mol·K}$,需将ΔG转换为J:
-
298.15K时:$\Delta G^\theta = -233.63 \, \text{kJ/mol} = -233630 \, \text{J/mol}$
$\ln K = -\frac{-233630}{8.314 \times 298.15} = \frac{233630}{2477} \approx 94.3$
$K = e^{94.3} \approx 10^{94.3/2.303} \approx 10^{40.9} \approx 8.3 \times 10^{40}$ -
373.15K时:$\Delta G^\theta = -243.05 \, \text{kJ/mol} = -243050 \, \text{J/mol}$
$\ln K = -\frac{-243050}{8.314 \times 373.15} = \frac{243050}{3104} \approx 78.3$
$K = e^{78.3} \approx 10^{78.3/2.303} \approx 10^{33.98} \approx 1.0 \times 10^{34}$