题目
已知 .10molcdot (L)^-1 元弱酸HB溶液的 =3.0, 则 .10molcdot (L)^-1 共轭碱NaB溶液的pH是-|||-A.11.0; B.9.0; C.8.5; D.9.5。
题目解答
答案
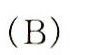
解析
步骤 1:计算弱酸HB的酸度常数Ka
已知 $0.10mol\cdot {L}^{-1}$ 一元弱酸HB溶液的 $PH=3.0$,则溶液中氢离子浓度 $[H^+] = 10^{-3} mol\cdot {L}^{-1}$。根据弱酸的解离平衡,$HB \rightleftharpoons H^+ + B^-$,可以得到酸度常数 $Ka = \frac{[H^+][B^-]}{[HB]}$。由于溶液中 $[H^+] = [B^-]$,且 $[HB] = 0.10 - [H^+]$,可以计算出 $Ka$。
步骤 2:计算共轭碱NaB的碱度常数Kb
根据酸碱共轭关系,$Kw = Ka \cdot Kb$,其中 $Kw = 10^{-14}$,可以计算出 $Kb$。
步骤 3:计算NaB溶液的pH
根据共轭碱NaB的解离平衡,$B^- + H_2O \rightleftharpoons HB + OH^-$,可以得到 $Kb = \frac{[HB][OH^-]}{[B^-]}$。由于溶液中 $[HB] = [OH^-]$,且 $[B^-] = 0.10 - [OH^-]$,可以计算出 $[OH^-]$,进而计算出 $pOH$ 和 $pH$。
已知 $0.10mol\cdot {L}^{-1}$ 一元弱酸HB溶液的 $PH=3.0$,则溶液中氢离子浓度 $[H^+] = 10^{-3} mol\cdot {L}^{-1}$。根据弱酸的解离平衡,$HB \rightleftharpoons H^+ + B^-$,可以得到酸度常数 $Ka = \frac{[H^+][B^-]}{[HB]}$。由于溶液中 $[H^+] = [B^-]$,且 $[HB] = 0.10 - [H^+]$,可以计算出 $Ka$。
步骤 2:计算共轭碱NaB的碱度常数Kb
根据酸碱共轭关系,$Kw = Ka \cdot Kb$,其中 $Kw = 10^{-14}$,可以计算出 $Kb$。
步骤 3:计算NaB溶液的pH
根据共轭碱NaB的解离平衡,$B^- + H_2O \rightleftharpoons HB + OH^-$,可以得到 $Kb = \frac{[HB][OH^-]}{[B^-]}$。由于溶液中 $[HB] = [OH^-]$,且 $[B^-] = 0.10 - [OH^-]$,可以计算出 $[OH^-]$,进而计算出 $pOH$ 和 $pH$。