题目
例1.1.1 用管道输送天然气,当输送压力为200kPa,温度为25 ℃时,管道内天然气的-|||-密度为多少?假设天然气可看做是纯的甲烷。

题目解答
答案
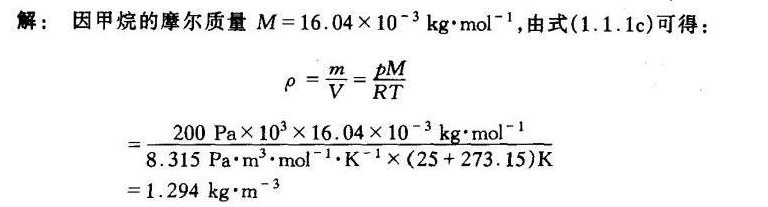
解析
步骤 1:确定已知条件
已知条件包括:输送压力 $P = 200\,kPa$,温度 $T = 25\,^\circ C$,假设天然气为纯甲烷,甲烷的摩尔质量 $M = 16.04 \times 10^{-3}\,kg\cdot mol^{-1}$。
步骤 2:转换温度单位
将温度从摄氏度转换为开尔文温度,$T = 25 + 273.15 = 298.15\,K$。
步骤 3:应用理想气体状态方程
理想气体状态方程为 $PV = nRT$,其中 $n$ 为物质的量,$R$ 为理想气体常数,$R = 8.314\,J\cdot mol^{-1}\cdot K^{-1}$。将物质的量 $n$ 用质量 $m$ 和摩尔质量 $M$ 表示,$n = \frac{m}{M}$,则有 $PV = \frac{m}{M}RT$。由此可得密度 $\rho = \frac{m}{V} = \frac{PM}{RT}$。
步骤 4:计算密度
将已知条件代入密度公式 $\rho = \frac{PM}{RT}$,计算得到 $\rho = \frac{200 \times 10^3 \times 16.04 \times 10^{-3}}{8.314 \times 298.15} = 1.294\,kg\cdot m^{-3}$。
已知条件包括:输送压力 $P = 200\,kPa$,温度 $T = 25\,^\circ C$,假设天然气为纯甲烷,甲烷的摩尔质量 $M = 16.04 \times 10^{-3}\,kg\cdot mol^{-1}$。
步骤 2:转换温度单位
将温度从摄氏度转换为开尔文温度,$T = 25 + 273.15 = 298.15\,K$。
步骤 3:应用理想气体状态方程
理想气体状态方程为 $PV = nRT$,其中 $n$ 为物质的量,$R$ 为理想气体常数,$R = 8.314\,J\cdot mol^{-1}\cdot K^{-1}$。将物质的量 $n$ 用质量 $m$ 和摩尔质量 $M$ 表示,$n = \frac{m}{M}$,则有 $PV = \frac{m}{M}RT$。由此可得密度 $\rho = \frac{m}{V} = \frac{PM}{RT}$。
步骤 4:计算密度
将已知条件代入密度公式 $\rho = \frac{PM}{RT}$,计算得到 $\rho = \frac{200 \times 10^3 \times 16.04 \times 10^{-3}}{8.314 \times 298.15} = 1.294\,kg\cdot m^{-3}$。