题目
镓、铁、钛等金属元素化合物的应用研究是当今前沿科学之一、回答下列问题:(1)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是 ____ 。(2)铁氮化合物晶体中铁原子为面心立方最密堆积,氮原子位于体心,其晶胞沿z轴的投影如图甲所示,Fel、N间最近距离为apm,则该晶体的晶胞参数为 ____ pm。bigcirc Fel-|||-bigcirc Fe2-|||-y-|||-bigcirc -x-|||-甲(3)图乙是一种由Fe、Y、Ba、O组成的晶胞,四方锥底面中心和八面体中心的球代表Fe.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,图中M点的分数坐标为(0,(1)/(2),(1)/(6))。bigcirc Fel-|||-bigcirc Fe2-|||-y-|||-bigcirc -x-|||-甲①Y的配位数为 ____ 。②Q点的分数坐标为 ____ 。(4)TiO2属于四方晶系,晶胞参数α=β=γ=90°。研究表明,TiO2通过氮掺杂反应生成TiOaNb,能使TiO2对可见光具有活性,反应如图丙所示。bigcirc Fel-|||-bigcirc Fe2-|||-y-|||-bigcirc -x-|||-甲①TiOaNb晶体化学式中a= ____ ,b= ____ 。②TiO2的密度为ρg•cm-3,则阿伏加德罗常数的值NA= ____ (列出表达式)。(5)金属合金MgCux的结构可看作以Cu4四面体(相互共用顶点)替换立方金刚石结构中的碳原子,形成三维骨架,在晶胞空隙处,有序地放置Mg原子(四面体的4个顶点代表Cu原子,圆球代表Mg原子),结构如图所示。bigcirc Fel-|||-bigcirc Fe2-|||-y-|||-bigcirc -x-|||-甲①x= ____ 。②若Mg原子A的原子坐标为(0.25,0.25,0.75),则C的原子坐标为 ____ 。③晶胞参数为anm,则AB原子之间的距离为 ____ nm。(用含a的代数式表示)
镓、铁、钛等金属元素化合物的应用研究是当今前沿科学之一、回答下列问题:
(1)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是 ____ 。
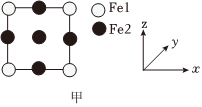
(2)铁氮化合物晶体中铁原子为面心立方最密堆积,氮原子位于体心,其晶胞沿z轴的投影如图甲所示,Fel、N间最近距离为apm,则该晶体的晶胞参数为 ____ pm。
(3)图乙是一种由Fe、Y、Ba、O组成的晶胞,四方锥底面中心和八面体中心的球代表Fe.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,图中M点的分数坐标为$(0,\frac{1}{2},\frac{1}{6})$。
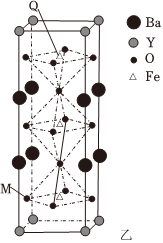
①Y的配位数为 ____ 。
②Q点的分数坐标为 ____ 。
(4)TiO2属于四方晶系,晶胞参数α=β=γ=90°。研究表明,TiO2通过氮掺杂反应生成TiOaNb,能使TiO2对可见光具有活性,反应如图丙所示。
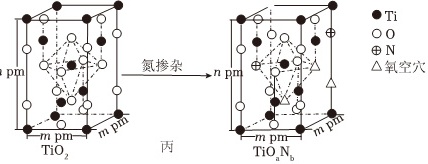
①TiOaNb晶体化学式中a= ____ ,b= ____ 。
②TiO2的密度为ρg•cm-3,则阿伏加德罗常数的值NA= ____ (列出表达式)。
(5)金属合金MgCux的结构可看作以Cu4四面体(相互共用顶点)替换立方金刚石结构中的碳原子,形成三维骨架,在晶胞空隙处,有序地放置Mg原子(四面体的4个顶点代表Cu原子,圆球代表Mg原子),结构如图所示。
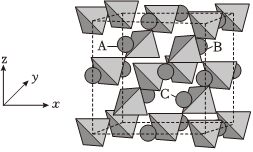
①x= ____ 。
②若Mg原子A的原子坐标为(0.25,0.25,0.75),则C的原子坐标为 ____ 。
③晶胞参数为anm,则AB原子之间的距离为 ____ nm。(用含a的代数式表示)
(1)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是 ____ 。
(2)铁氮化合物晶体中铁原子为面心立方最密堆积,氮原子位于体心,其晶胞沿z轴的投影如图甲所示,Fel、N间最近距离为apm,则该晶体的晶胞参数为 ____ pm。

(3)图乙是一种由Fe、Y、Ba、O组成的晶胞,四方锥底面中心和八面体中心的球代表Fe.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,图中M点的分数坐标为$(0,\frac{1}{2},\frac{1}{6})$。

①Y的配位数为 ____ 。
②Q点的分数坐标为 ____ 。
(4)TiO2属于四方晶系,晶胞参数α=β=γ=90°。研究表明,TiO2通过氮掺杂反应生成TiOaNb,能使TiO2对可见光具有活性,反应如图丙所示。

①TiOaNb晶体化学式中a= ____ ,b= ____ 。
②TiO2的密度为ρg•cm-3,则阿伏加德罗常数的值NA= ____ (列出表达式)。
(5)金属合金MgCux的结构可看作以Cu4四面体(相互共用顶点)替换立方金刚石结构中的碳原子,形成三维骨架,在晶胞空隙处,有序地放置Mg原子(四面体的4个顶点代表Cu原子,圆球代表Mg原子),结构如图所示。

①x= ____ 。
②若Mg原子A的原子坐标为(0.25,0.25,0.75),则C的原子坐标为 ____ 。
③晶胞参数为anm,则AB原子之间的距离为 ____ nm。(用含a的代数式表示)
题目解答
答案
解:(1)晶体类型是决定物质熔、沸点的主要因素,从GaF3的熔点较高知其为离子晶体,从GaCl3的熔点较低知其为分子晶体,一般来说,离子晶体的熔点高于分子晶体的熔点,故原因为GaF3为离子晶体,GaCl3为分子晶体,
故答案为:GaF3为离子晶体,GaCl3为分子晶体;
(2)设该晶胞的边长为x,由晶胞投影图知,Fel位于晶胞顶点,由于氮原子位于体心,Fel、N间最近距离为apm,则$(\frac{x}{2})^{2}+(\frac{\sqrt{2}}{2}x)^{2}={a}^{2}$,解得$x=\frac{2\sqrt{3}}{3}a$,故该晶体的晶胞参数为$\frac{2\sqrt{3}a}{3}$pm,
故答案为:$\frac{2\sqrt{3}a}{3}$;
(3)①Y在晶胞中处于顶点位置,在一个晶胞中离Y等距且最近的是氧原子且氧原子为两个,每个顶点由八个晶胞共有,每个氧原子由两个晶胞共有,故Y的配位数为8,
故答案为:8;
②M点在左侧面,分数坐标为$(0,\frac{1}{2},\frac{1}{6})$,由图知,Q点在体内,分数坐标为$(\frac{1}{2},\frac{1}{2},\frac{5}{6})$,
故答案为:$(\frac{1}{2},\frac{1}{2},\frac{5}{6})$;
(4)①TiOaNb晶胞中含Ti:$8×\frac{1}{8}+4×\frac{1}{2}+1=4$个,含O:$6×\frac{1}{4}+6×\frac{1}{2}+1=\frac{11}{2}$个,含N:$\frac{1}{4}+\frac{1}{2}=\frac{3}{4}$个,所以化学式TiOaNb中a=$\frac{11}{2}÷4=\frac{11}{8}$,b=$\frac{3}{4}÷4=\frac{3}{16}$,
故答案为:$\frac{11}{8}$;$\frac{3}{16}$;
②TiO2晶胞中含Ti:$8×\frac{1}{8}+4×\frac{1}{2}+1=4$个,则密度$ρ=\frac{m}{V}=\frac{4×(48+32)}{{N}_{A}×{m}^{2}n×1{0}^{-30}}g•c{m}^{-3}=\frac{320}{{N}_{A}×{m}^{2}n×1{0}^{-30}}g•c{m}^{-3}$,整理可得阿伏加德罗常数的值NA=$\frac{320}{{m}^{2}nρ×1{0}^{-30}}$,
故答案为:$\frac{320}{{m}^{2}nρ×1{0}^{-30}}$;
(5)①由图可知Cu4位于顶点、面心和四个四面体空隙,根据均摊法可得个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,每个铜原子由两个四面体共用,因此铜原子个数为8×4×$\frac{1}{2}$=16,Mg原子位于四个四面体空隙和八面体空隙,八面体空隙有12×$\frac{1}{4}$+1=4个,因此Mg原子有8个,由此可知化学式为MgCu2,即x=2,
故答案为:2;
②由图可知,A原子位于左前上四面体空隙,C原子位于右前下四面体空隙,因此二者y坐标相同,x、z坐标相加为1,即C坐标为(0.75,0.25,0.25),
故答案为:(0.75,0.25,0.25);
③由图可知,AB原子之间的距离为面对角线的一半,晶胞参数为anm,则AB之间的距离为$\frac{\sqrt{2}}{2}a$,
故答案为:$\frac{\sqrt{2}}{2}a$。
故答案为:GaF3为离子晶体,GaCl3为分子晶体;
(2)设该晶胞的边长为x,由晶胞投影图知,Fel位于晶胞顶点,由于氮原子位于体心,Fel、N间最近距离为apm,则$(\frac{x}{2})^{2}+(\frac{\sqrt{2}}{2}x)^{2}={a}^{2}$,解得$x=\frac{2\sqrt{3}}{3}a$,故该晶体的晶胞参数为$\frac{2\sqrt{3}a}{3}$pm,
故答案为:$\frac{2\sqrt{3}a}{3}$;
(3)①Y在晶胞中处于顶点位置,在一个晶胞中离Y等距且最近的是氧原子且氧原子为两个,每个顶点由八个晶胞共有,每个氧原子由两个晶胞共有,故Y的配位数为8,
故答案为:8;
②M点在左侧面,分数坐标为$(0,\frac{1}{2},\frac{1}{6})$,由图知,Q点在体内,分数坐标为$(\frac{1}{2},\frac{1}{2},\frac{5}{6})$,
故答案为:$(\frac{1}{2},\frac{1}{2},\frac{5}{6})$;
(4)①TiOaNb晶胞中含Ti:$8×\frac{1}{8}+4×\frac{1}{2}+1=4$个,含O:$6×\frac{1}{4}+6×\frac{1}{2}+1=\frac{11}{2}$个,含N:$\frac{1}{4}+\frac{1}{2}=\frac{3}{4}$个,所以化学式TiOaNb中a=$\frac{11}{2}÷4=\frac{11}{8}$,b=$\frac{3}{4}÷4=\frac{3}{16}$,
故答案为:$\frac{11}{8}$;$\frac{3}{16}$;
②TiO2晶胞中含Ti:$8×\frac{1}{8}+4×\frac{1}{2}+1=4$个,则密度$ρ=\frac{m}{V}=\frac{4×(48+32)}{{N}_{A}×{m}^{2}n×1{0}^{-30}}g•c{m}^{-3}=\frac{320}{{N}_{A}×{m}^{2}n×1{0}^{-30}}g•c{m}^{-3}$,整理可得阿伏加德罗常数的值NA=$\frac{320}{{m}^{2}nρ×1{0}^{-30}}$,
故答案为:$\frac{320}{{m}^{2}nρ×1{0}^{-30}}$;
(5)①由图可知Cu4位于顶点、面心和四个四面体空隙,根据均摊法可得个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,每个铜原子由两个四面体共用,因此铜原子个数为8×4×$\frac{1}{2}$=16,Mg原子位于四个四面体空隙和八面体空隙,八面体空隙有12×$\frac{1}{4}$+1=4个,因此Mg原子有8个,由此可知化学式为MgCu2,即x=2,
故答案为:2;
②由图可知,A原子位于左前上四面体空隙,C原子位于右前下四面体空隙,因此二者y坐标相同,x、z坐标相加为1,即C坐标为(0.75,0.25,0.25),
故答案为:(0.75,0.25,0.25);
③由图可知,AB原子之间的距离为面对角线的一半,晶胞参数为anm,则AB之间的距离为$\frac{\sqrt{2}}{2}a$,
故答案为:$\frac{\sqrt{2}}{2}a$。