题目
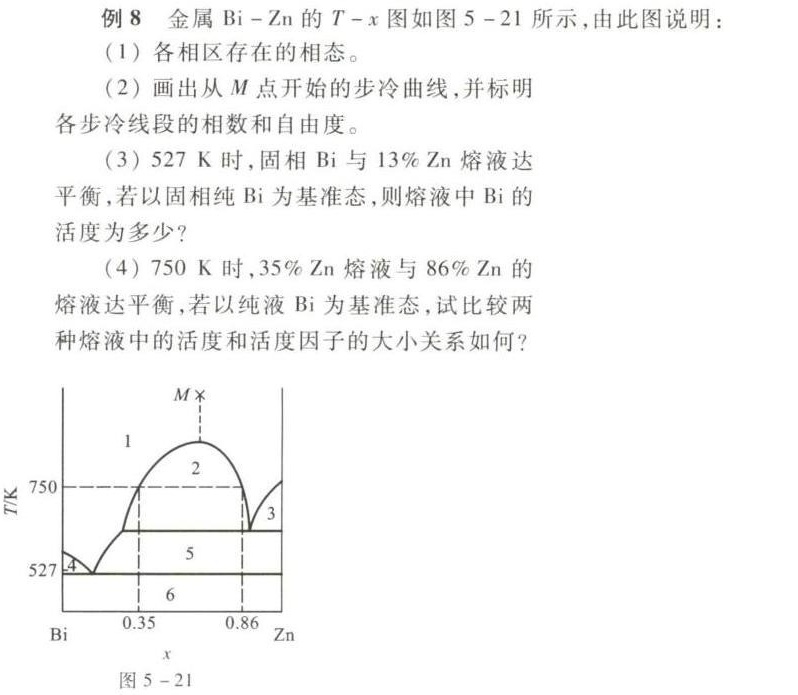
例8 金属 Bi-Zn 的 T-x 图如图 5-21 所示,由此图说明:-|||-(1)各相区存在的相态。-|||-(2)画出从M点开始的步冷曲线,并标明-|||-各步冷线段的相数和自由度。-|||-(3)527K时,固相Bi与13%Zn熔液达-|||-平衡,若以固相纯Bi为基准态,则熔液中Bi的-|||-活度为多少?-|||-(4)750K时,35%Zn熔液与86%Zn的-|||-熔液达平衡,若以纯液Bi为基准态,试比较两-|||-种熔液中的活度和活度因子的大小关系如何?-|||-M×-|||-1-|||-2-|||-750-|||-3-|||-527 4 5-|||-6-|||-Bi 0.35 0.86 Zn-|||-x-|||-图
题目解答
答案

解析
步骤 1:确定各相区存在的相态
根据T-x图,我们可以确定各相区存在的相态。相区1为液相,相区2为液相和液相的混合,相区3为液相和固相的混合,相区4为固相和固相的混合,相区5为液相和固相的混合,相区6为固相和固相的混合。
步骤 2:绘制从M点开始的步冷曲线
从M点开始,随着温度的降低,系统会经历不同的相区,每进入一个新的相区,步冷曲线的斜率会发生变化。在相区1,系统为液相,步冷曲线斜率较大;进入相区2,系统为液相和液相的混合,步冷曲线斜率减小;进入相区3,系统为液相和固相的混合,步冷曲线斜率进一步减小;进入相区4,系统为固相和固相的混合,步冷曲线斜率再次减小;进入相区5,系统为液相和固相的混合,步冷曲线斜率再次减小;进入相区6,系统为固相和固相的混合,步冷曲线斜率再次减小。在每个相区,步冷曲线的斜率与相数和自由度有关。
步骤 3:计算527K时熔液中Bi的活度
在527K时,固相Bi与13%Zn熔液达平衡,Bi在两相中的化学势相等。以固相纯Bi为基准态,熔液中Bi的活度为 ${a}_{Bi} = \frac{x_{Bi}}{x_{Bi}^{0}}$,其中 $x_{Bi}$ 为熔液中Bi的摩尔分数,$x_{Bi}^{0}$ 为基准态下Bi的摩尔分数。由于基准态为纯Bi,$x_{Bi}^{0} = 1$,因此 ${a}_{Bi} = x_{Bi}$。在13%Zn熔液中,Bi的摩尔分数为 $x_{Bi} = 1 - 0.13 = 0.87$,因此 ${a}_{Bi} = 0.87$。
步骤 4:比较750K时两种熔液中的活度和活度因子的大小关系
在750K时,35%Zn熔液与86%Zn的熔液达平衡,Bi在两相中的化学势相等。以纯液Bi为基准态,两种熔液中Bi的活度分别为 ${a}_{Bi}^{1} = x_{Bi}^{1}$ 和 ${a}_{Bi}^{2} = x_{Bi}^{2}$,其中 $x_{Bi}^{1}$ 和 $x_{Bi}^{2}$ 分别为两种熔液中Bi的摩尔分数。由于 $x_{Bi}^{1} = 1 - 0.35 = 0.65$,$x_{Bi}^{2} = 1 - 0.86 = 0.14$,因此 ${a}_{Bi}^{1} = 0.65$,${a}_{Bi}^{2} = 0.14$。由于 ${a}_{Bi}^{1} > {a}_{Bi}^{2}$,因此35%Zn熔液中Bi的活度大于86%Zn熔液中Bi的活度。活度因子为 ${\gamma}_{Bi} = \frac{a_{Bi}}{x_{Bi}}$,因此35%Zn熔液中Bi的活度因子大于86%Zn熔液中Bi的活度因子。
根据T-x图,我们可以确定各相区存在的相态。相区1为液相,相区2为液相和液相的混合,相区3为液相和固相的混合,相区4为固相和固相的混合,相区5为液相和固相的混合,相区6为固相和固相的混合。
步骤 2:绘制从M点开始的步冷曲线
从M点开始,随着温度的降低,系统会经历不同的相区,每进入一个新的相区,步冷曲线的斜率会发生变化。在相区1,系统为液相,步冷曲线斜率较大;进入相区2,系统为液相和液相的混合,步冷曲线斜率减小;进入相区3,系统为液相和固相的混合,步冷曲线斜率进一步减小;进入相区4,系统为固相和固相的混合,步冷曲线斜率再次减小;进入相区5,系统为液相和固相的混合,步冷曲线斜率再次减小;进入相区6,系统为固相和固相的混合,步冷曲线斜率再次减小。在每个相区,步冷曲线的斜率与相数和自由度有关。
步骤 3:计算527K时熔液中Bi的活度
在527K时,固相Bi与13%Zn熔液达平衡,Bi在两相中的化学势相等。以固相纯Bi为基准态,熔液中Bi的活度为 ${a}_{Bi} = \frac{x_{Bi}}{x_{Bi}^{0}}$,其中 $x_{Bi}$ 为熔液中Bi的摩尔分数,$x_{Bi}^{0}$ 为基准态下Bi的摩尔分数。由于基准态为纯Bi,$x_{Bi}^{0} = 1$,因此 ${a}_{Bi} = x_{Bi}$。在13%Zn熔液中,Bi的摩尔分数为 $x_{Bi} = 1 - 0.13 = 0.87$,因此 ${a}_{Bi} = 0.87$。
步骤 4:比较750K时两种熔液中的活度和活度因子的大小关系
在750K时,35%Zn熔液与86%Zn的熔液达平衡,Bi在两相中的化学势相等。以纯液Bi为基准态,两种熔液中Bi的活度分别为 ${a}_{Bi}^{1} = x_{Bi}^{1}$ 和 ${a}_{Bi}^{2} = x_{Bi}^{2}$,其中 $x_{Bi}^{1}$ 和 $x_{Bi}^{2}$ 分别为两种熔液中Bi的摩尔分数。由于 $x_{Bi}^{1} = 1 - 0.35 = 0.65$,$x_{Bi}^{2} = 1 - 0.86 = 0.14$,因此 ${a}_{Bi}^{1} = 0.65$,${a}_{Bi}^{2} = 0.14$。由于 ${a}_{Bi}^{1} > {a}_{Bi}^{2}$,因此35%Zn熔液中Bi的活度大于86%Zn熔液中Bi的活度。活度因子为 ${\gamma}_{Bi} = \frac{a_{Bi}}{x_{Bi}}$,因此35%Zn熔液中Bi的活度因子大于86%Zn熔液中Bi的活度因子。