将298K,p下的1dm3的O2(理想气体)绝热不可逆压缩到5p,消耗功502J,求终态的T2、S2及△H、△G。已知:Sm(O2,298K)= 205.14 J·K-1·mol-1。氧气的物质的量为n=pp/Mn=18q(n(x+1n(x+0)/(由热力学第一定律,△U = Q + W;系统绝热,Q = 0 ,△U = W△U = nCV,m(T2-T1)= 0.4mol ×2.5R×(T2-298K)=502J解得T2 = 896.4Kn=pp/Mn=18q(n(x+1n(x+0)/(n=pp/Mn=18q(n(x+1n(x+0)/(△S2 = △S + S1= 7.4 J×K-1+205.14J×K-1×mol-1×0.40mol = 89.46 J×K-1△H = nCp,m(T2-T1)= 0.4mol×3.5R×(698.4-298)K = 6965.1J△G =△H -△(TS)= △H -(T2S2-T1S1)=6965.1J-(896.4K·89.46 J·K-1-298K×0.4mol·05.14J·K-1·mol-1)=-48.77kJ2.1 mol单原子理想气体温度为273 K,压强为,试计算经下列变化后的。设在此条件下气体的摩尔熵为100 J·mol·K。(1)在恒压下体积增加1倍;(2)在恒容下压强增加1倍;(3)在恒温下压强增加1倍。(答案:① -29.49 kJ·mol-1,② -26.34 kJ·mol-1,③ 1.573 kJ·mol)
将298K,p下的1dm3的O2(理想气体)绝热不可逆压缩到5p,消耗功502J,求终态的T2、S2及△H、△G。已知:Sm(O2,298K)= 205.14 J·K-1·mol-1。
氧气的物质的量为
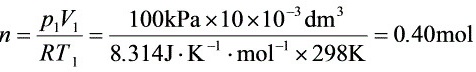
由热力学第一定律,△U = Q + W;系统绝热,Q = 0 ,△U = W
△U = nCV,m(T2-T1)= 0.4mol ×2.5R×(T2-298K)=502J
解得T2 = 896.4K
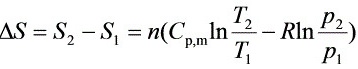
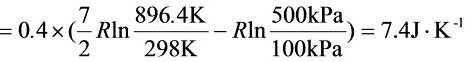
△S2 = △S + S1
= 7.4 J×K-1+205.14J×K-1×mol-1×0.40mol = 89.46 J×K-1
△H = nCp,m(T2-T1)= 0.4mol×3.5R×(698.4-298)K = 6965.1J
△G =△H -△(TS)= △H -(T2S2-T1S1)
=6965.1J-(896.4K·89.46 J·K-1-298K×0.4mol·05.14J·K-1·mol-1)
=-48.77kJ
2.1 mol单原子理想气体温度为273 K,压强为,试计算经下列变化后的。设在此条件下气体的摩尔熵为100 J·mol·K。(1)在恒压下体积增加1倍;(2)在恒容下压强增加1倍;(3)在恒温下压强增加1倍。
(答案:① -29.49 kJ·mol-1,② -26.34 kJ·mol-1,③ 1.573 kJ·mol)
题目解答
答案
解: (1) 恒压下 有:dS=CpdT/T,积分得:ST=CplnT+C
在273 K时有:100=20.785ln273+C, 可得C= -16.59
所以:ST=20.785lnT-16.59
又因:dG= -SdT
所以: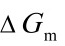 =
=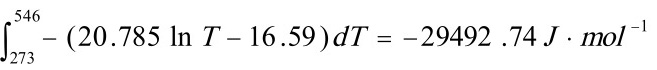
(2) 恒容下 有:dS=CvdT/T,积分得:ST= 12.47lnT+C
在273 K时有: 100=12.47ln273+C 可得: C=30.05
所以:ST=12.47lnT+30.05,T2=2T1=546 K,S2=12.47ln546+30.05=108.64 J·mol-1·K-1
Hm=Cp,mT= 5674 J,Gm = Hm - (TS) = Hm – (T2S2-T1S1) = -26345 J·mol-1
(3) 恒温下: dG=VdP=(RT/P)dP
所以: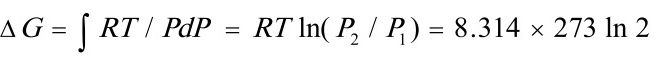 =1573 J·mol-1
=1573 J·mol-1
解析
氧气的物质的量为
步骤 2:计算终态温度T2
由热力学第一定律,△U = Q + W;系统绝热,Q = 0 ,△U = W
△U = nCV,m(T2-T1)= 0.4mol ×2.5R×(T2-298K)=502J
解得T2 = 896.4K
步骤 3:计算熵变△S
$\Delta S={S}_{2}-{S}_{1}=n({C}_{Pm}\ln \dfrac {{T}_{2}}{{T}_{1}}-R\ln \dfrac {{P}_{2}}{{P}_{1}})$
$=0.4\times (\dfrac {7}{2}R\ln \dfrac {896.4k}{298k}-R\ln \dfrac {500kpa}{100kpa})=7.45\cdot {k}^{-1}$
步骤 4:计算终态熵S2
△S2 = △S + S1
= 7.4 J×K-1+205.14J×K-1×mol-1×0.40mol = 89.46 J×K-1
步骤 5:计算焓变△H
△H = nCp,m(T2-T1)= 0.4mol×3.5R×(698.4-298)K = 6965.1J
步骤 6:计算吉布斯自由能变△G
△G =△H -△(TS)= △H -(T2S2-T1S1)
=6965.1J-(896.4K·89.46 J·K-1-298K×0.4mol·05.14J·K-1·mol-1)
=-48.77kJ