题目
6.气相基元反应 +2Barrow 2P 在30℃和常压下的反应速率常数 _(c)=2.65times (10)^4(m)^6-|||--2cdot (s)^-1 现以气相分压来表示速率方程,即 (-(r)_(A))=(k)_(P)(PAP{B)^2} ,求 _(P)=(P)_(()) 假定气体-|||-为理想气体)

题目解答
答案
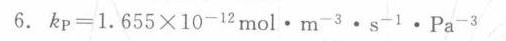
解析
步骤 1:理解速率常数的转换
速率常数 ${k}_{c}$ 是以浓度表示的反应速率常数,而 ${k}_{P}$ 是以分压表示的反应速率常数。对于理想气体,浓度和分压之间可以通过理想气体状态方程 $PV=nRT$ 联系起来,其中 $P$ 是分压,$V$ 是体积,$n$ 是物质的量,$R$ 是理想气体常数,$T$ 是温度。
步骤 2:计算浓度与分压的关系
对于反应 $A+2B\rightarrow 2P$,反应速率常数 ${k}_{c}$ 与 ${k}_{P}$ 之间的关系为 ${k}_{c} = {k}_{P} (RT)^{-3}$,其中 $-3$ 是反应物的总摩尔数($A$ 的摩尔数为1,$B$ 的摩尔数为2,总摩尔数为3)。
步骤 3:计算 ${k}_{P}$
将 ${k}_{c}$ 和理想气体常数 $R$ 代入上述关系式中,计算 ${k}_{P}$ 的值。理想气体常数 $R$ 在SI单位制下为 $8.314 J\cdot mol^{-1}\cdot K^{-1}$,温度 $T$ 为30℃,即303.15K。
${k}_{P} = {k}_{c} (RT)^{3} = 2.65\times {10}^{4} \times (8.314 \times 303.15)^{-3}$
计算得到 ${k}_{P}$ 的值。
速率常数 ${k}_{c}$ 是以浓度表示的反应速率常数,而 ${k}_{P}$ 是以分压表示的反应速率常数。对于理想气体,浓度和分压之间可以通过理想气体状态方程 $PV=nRT$ 联系起来,其中 $P$ 是分压,$V$ 是体积,$n$ 是物质的量,$R$ 是理想气体常数,$T$ 是温度。
步骤 2:计算浓度与分压的关系
对于反应 $A+2B\rightarrow 2P$,反应速率常数 ${k}_{c}$ 与 ${k}_{P}$ 之间的关系为 ${k}_{c} = {k}_{P} (RT)^{-3}$,其中 $-3$ 是反应物的总摩尔数($A$ 的摩尔数为1,$B$ 的摩尔数为2,总摩尔数为3)。
步骤 3:计算 ${k}_{P}$
将 ${k}_{c}$ 和理想气体常数 $R$ 代入上述关系式中,计算 ${k}_{P}$ 的值。理想气体常数 $R$ 在SI单位制下为 $8.314 J\cdot mol^{-1}\cdot K^{-1}$,温度 $T$ 为30℃,即303.15K。
${k}_{P} = {k}_{c} (RT)^{3} = 2.65\times {10}^{4} \times (8.314 \times 303.15)^{-3}$
计算得到 ${k}_{P}$ 的值。