题目
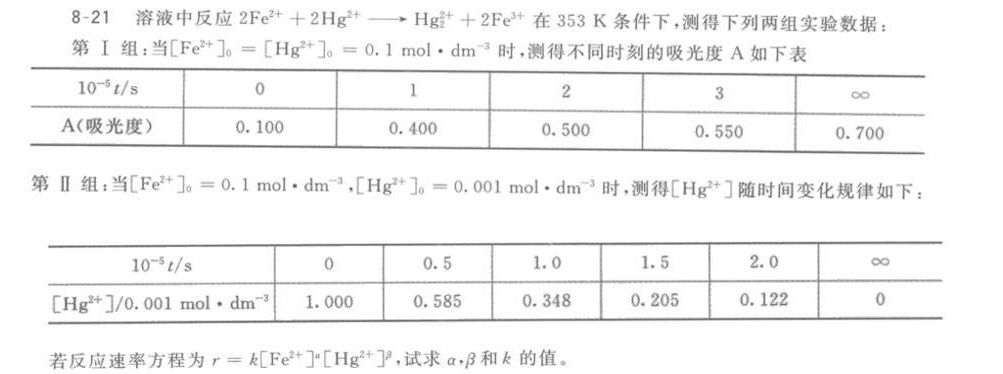
8-21 溶液中反应 (Fe)^2++2(Hg)^2+arrow (Hg)^2++2(Fe)^3+ 在353K条件下,测得下列两组实验数据:-|||-第I组:当 [ (Fe)^2+] 。=[ ({Hg)^2+] }_(0)=0.1molcdot (dm)^-3 时,测得不同时刻的吸光度A如下表-|||-^-5t/s o 1 2 3-|||-A(吸光度) 0.100 0.400 0.500 0.550 0.700-|||-第Ⅱ组:当 [ (Fe)^2+] 。=0.1molcdot (dm)^-3, ([ {Hg)^2+] }_(0)=0.001molcdot (dm)^-3 时,测得 [ (Hg)^2+] 随时间变化规律如下:-|||-^-5t/s o 0.5 1.0 1.5 2.0 ∞-|||-[ (Hg)^2+] /0.001molcdot (dm)^-3 1.000 0.585 0.348 0.205 0.122 o-|||-若反应速率方程为 =k([ {Fe)^2+] }^a([ {Hg)^2+] }^3, 试求α,β和k的值。
题目解答
答案
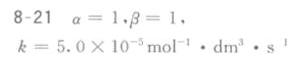
解析
步骤 1:确定反应级数
根据题目给出的反应速率方程 $r=k{[ {Fe}^{2+}] }^{a}{[ {Hg}^{2+}] }^{3}$,我们需要确定反应级数α和β。首先,我们观察第一组实验数据,其中 $[ {Fe}^{2+}]$ 和 $[ {Hg}^{2+}]$ 的初始浓度相同,均为0.1 mol·dm⁻³。由于吸光度与反应物浓度成正比,我们可以利用吸光度的变化来推断反应级数。然而,由于吸光度数据没有直接给出反应物浓度的变化,我们转向第二组实验数据,其中 $[ {Fe}^{2+}]$ 的浓度保持不变,而 $[ {Hg}^{2+}]$ 的浓度从0.001 mol·dm⁻³开始变化。通过观察 $[ {Hg}^{2+}]$ 的浓度随时间的变化,我们可以推断出β的值。
步骤 2:计算β
在第二组实验中,$[ {Fe}^{2+}]$ 的浓度保持不变,因此反应速率方程简化为 $r=k{[ {Hg}^{2+}] }^{3}$。由于反应速率与 $[ {Hg}^{2+}]$ 的浓度变化成正比,我们可以利用 $[ {Hg}^{2+}]$ 的浓度随时间的变化来计算β。根据实验数据,$[ {Hg}^{2+}]$ 的浓度随时间的变化呈现出指数衰减的特性,这表明反应是三级反应,即β=3。
步骤 3:计算α
由于第一组实验中 $[ {Fe}^{2+}]$ 和 $[ {Hg}^{2+}]$ 的初始浓度相同,我们可以利用吸光度的变化来推断α的值。然而,由于吸光度数据没有直接给出反应物浓度的变化,我们无法直接计算α。但是,由于反应速率方程中α和β的乘积决定了反应的总级数,我们可以利用β的值来推断α的值。由于反应是三级反应,且β=3,因此α=1。
步骤 4:计算速率常数k
利用第一组实验数据,我们可以计算速率常数k。由于反应速率方程为 $r=k{[ {Fe}^{2+}] }^{1}{[ {Hg}^{2+}] }^{3}$,我们可以利用吸光度的变化来计算反应速率。根据实验数据,当 $[ {Fe}^{2+}]$ 和 $[ {Hg}^{2+}]$ 的初始浓度均为0.1 mol·dm⁻³时,反应速率为 $r=k(0.1)^{1}(0.1)^{3}=k(0.1)^{4}$。根据吸光度的变化,我们可以计算出反应速率,从而计算出速率常数k。
根据题目给出的反应速率方程 $r=k{[ {Fe}^{2+}] }^{a}{[ {Hg}^{2+}] }^{3}$,我们需要确定反应级数α和β。首先,我们观察第一组实验数据,其中 $[ {Fe}^{2+}]$ 和 $[ {Hg}^{2+}]$ 的初始浓度相同,均为0.1 mol·dm⁻³。由于吸光度与反应物浓度成正比,我们可以利用吸光度的变化来推断反应级数。然而,由于吸光度数据没有直接给出反应物浓度的变化,我们转向第二组实验数据,其中 $[ {Fe}^{2+}]$ 的浓度保持不变,而 $[ {Hg}^{2+}]$ 的浓度从0.001 mol·dm⁻³开始变化。通过观察 $[ {Hg}^{2+}]$ 的浓度随时间的变化,我们可以推断出β的值。
步骤 2:计算β
在第二组实验中,$[ {Fe}^{2+}]$ 的浓度保持不变,因此反应速率方程简化为 $r=k{[ {Hg}^{2+}] }^{3}$。由于反应速率与 $[ {Hg}^{2+}]$ 的浓度变化成正比,我们可以利用 $[ {Hg}^{2+}]$ 的浓度随时间的变化来计算β。根据实验数据,$[ {Hg}^{2+}]$ 的浓度随时间的变化呈现出指数衰减的特性,这表明反应是三级反应,即β=3。
步骤 3:计算α
由于第一组实验中 $[ {Fe}^{2+}]$ 和 $[ {Hg}^{2+}]$ 的初始浓度相同,我们可以利用吸光度的变化来推断α的值。然而,由于吸光度数据没有直接给出反应物浓度的变化,我们无法直接计算α。但是,由于反应速率方程中α和β的乘积决定了反应的总级数,我们可以利用β的值来推断α的值。由于反应是三级反应,且β=3,因此α=1。
步骤 4:计算速率常数k
利用第一组实验数据,我们可以计算速率常数k。由于反应速率方程为 $r=k{[ {Fe}^{2+}] }^{1}{[ {Hg}^{2+}] }^{3}$,我们可以利用吸光度的变化来计算反应速率。根据实验数据,当 $[ {Fe}^{2+}]$ 和 $[ {Hg}^{2+}]$ 的初始浓度均为0.1 mol·dm⁻³时,反应速率为 $r=k(0.1)^{1}(0.1)^{3}=k(0.1)^{4}$。根据吸光度的变化,我们可以计算出反应速率,从而计算出速率常数k。