习题:2-1.为什么要研究流体的pVT关系?答:在化工过程的分析、研究与设计中,流体的压力p、体积V和温度T是流体最基本的性质之一,并且是可以通过实验直接测量的。而许多其它的热力学性质如内能U、熵S、Gibbs自由能G等都不方便直接测量,它们需要利用流体的p –V –T数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过p –V –T数据和热力学基本关系式进行计算。因此,流体的p –V –T关系的研究是一项重要的基础工作。2-2.理想气体的特征是什么?答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。理想气体状态方程是最简单的状态方程:2-3.偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?答:纯物质的偏心因子是根据物质的蒸气压来定义的。实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合: 其中,对于不同的流体,具有不同的值。但Pitzer发现,简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过=0.7,这一点。对于给定流体对比蒸气压曲线的位置,能够用在=0.7的流体与氩、氪、氙(简单球形分子)的值之差来表征。Pitzer把这一差值定义为偏心因子,即任何流体的值都不是直接测量的,均由该流体的临界温度、临界压力值及=0.7时的饱和蒸气压来确定。2-4.纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而减小吗?答:正确。由纯物质的p –V图上的饱和蒸气和饱和液体曲线可知。2-5.同一温度下,纯物质的饱和液体与饱和蒸气的热力学性质均不同吗?产品的摩尔流率为:反应物摩尔流率×3.7/4=1.022×105×3/4=9.45×104产品的体积流率为:速率2-27.测得天然气(摩尔组成为CH484%、N29%、C2H67%)在压力9.27MPa、温度37.8℃下的平均时速为25。试用下述方法计算在标准状况下的气体流速。(1)理想气体方程;(2)虚拟临界参数;(3)Dalton定律和普遍化压缩因子图;(4)Amagat定律和普遍化压缩因子图。
习题:
2-1.为什么要研究流体的pVT关系?
答:在化工过程的分析、研究与设计中,流体的压力p、体积V和温度T是流体最基本的性质之一,并且是可以通过实验直接测量的。而许多其它的热力学性质如内能U、熵S、Gibbs自由能G等都不方便直接测量,它们需要利用流体的p –V –T数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过p –V –T数据和热力学基本关系式进行计算。因此,流体的p –V –T关系的研究是一项重要的基础工作。
2-2.理想气体的特征是什么?
答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。
理想气体状态方程是最简单的状态方程:
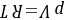
2-3.偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?
答:纯物质的偏心因子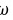 是根据物质的蒸气压来定义的。实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合:
是根据物质的蒸气压来定义的。实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合:
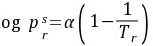 其中,
其中,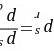
对于不同的流体,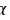 具有不同的值。但Pitzer发现,简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过
具有不同的值。但Pitzer发现,简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过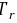 =0.7,
=0.7,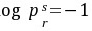 这一点。对于给定流体对比蒸气压曲线的位置,能够用在
这一点。对于给定流体对比蒸气压曲线的位置,能够用在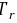 =0.7的流体与氩、氪、氙(简单球形分子)的
=0.7的流体与氩、氪、氙(简单球形分子)的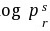 值之差来表征。
值之差来表征。
Pitzer把这一差值定义为偏心因子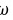 ,即
,即
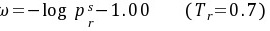
任何流体的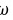 值都不是直接测量的,均由该流体的临界温度
值都不是直接测量的,均由该流体的临界温度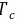 、临界压力
、临界压力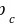 值及
值及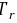 =0.7时的饱和蒸气压
=0.7时的饱和蒸气压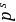 来确定。
来确定。
2-4.纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而减小吗?
答:正确。由纯物质的p –V图上的饱和蒸气和饱和液体曲线可知。
2-5.同一温度下,纯物质的饱和液体与饱和蒸气的热力学性质均不同吗?
产品的摩尔流率为:反应物摩尔流率×3.7/4=1.022×105×3/4=9.45×104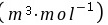
产品的体积流率为:
速率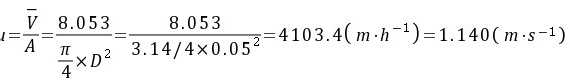
2-27.测得天然气(摩尔组成为CH484%、N29%、C2H67%)在压力9.27MPa、温度37.8℃下的平均时速为25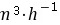 。试用下述方法计算在标准状况下的气体流速。
。试用下述方法计算在标准状况下的气体流速。
(1)理想气体方程;
(2)虚拟临界参数;
(3)Dalton定律和普遍化压缩因子图;
(4)Amagat定律和普遍化压缩因子图。
题目解答
答案
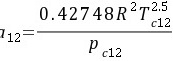
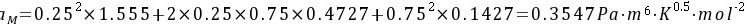
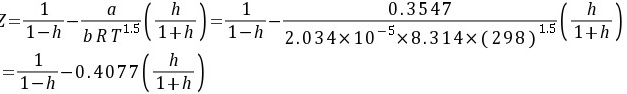
进行试差迭代得: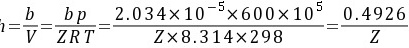 h=0.244
h=0.244
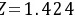
所以以进口N2为1mol作基准
入口总物质的量为:1+3+0=4mol
出口总物质的量为:1×(1-0.15)+3×(1-0.15)+1×0.15×2=3.7mol