题目
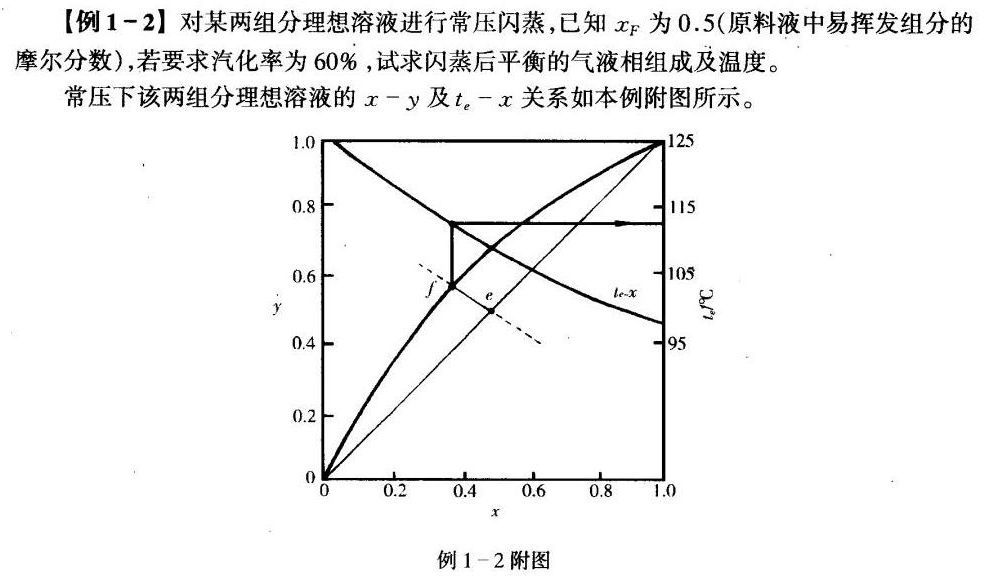
【例 1-2 ]对某两组分理想溶液进行常压闪蒸,已知xF为0.5(原料液中易挥发组分的-|||-摩尔分数),若要求汽化率为60%,试求闪蒸后平衡的气液相组成及温度。-|||-常压下该两组分理想溶液的 x-y 及 _(e)-x 关系如本例附图所示。-|||-1.0 125-|||-0.8 115-|||-0.6 105-|||-f e le-x-|||-y-|||-0.4 95-|||-0.2-|||-0-|||-0 0.2 0.4 0.6 0.8 1.0-|||-x-|||-例 1-2 附图
题目解答
答案

解析
步骤 1:确定汽化率和原料液组成
已知原料液中易挥发组分的摩尔分数 $x_F = 0.5$,汽化率为60%,即 $V/F = 0.6$,其中 $V$ 为汽化量,$F$ 为原料液量。因此,液化率为 $L/F = 1 - V/F = 0.4$。
步骤 2:计算相平衡关系
根据相平衡关系,我们有:
$$
\dfrac{L}{F} = 1 - \dfrac{V}{F} = 0.4
$$
$$
\dfrac{V}{F} = 0.6
$$
因此,相平衡关系的斜率为:
$$
\dfrac{L}{V} = \dfrac{0.4}{0.6} = \dfrac{2}{3} = -0.667
$$
斜率为负值是因为气相中易挥发组分的摩尔分数 $y$ 高于液相中易挥发组分的摩尔分数 $x$。
步骤 3:确定气液相组成
在 x-y 图中,通过点 $e(0.5, 0.5)$ 作斜率为 $-0.667$ 的直线 $ef$,该直线与 x-y 平衡曲线的交点 $f$ 的坐标即为平衡的气液相组成。根据图示,可以得到:
$$
x \approx 0.387
$$
$$
y \approx 0.575
$$
步骤 4:确定平衡温度
根据 ${t}_{e}-x$ 曲线,从 $x = 0.387$ 可求得平衡温度:
$$
{t}_{e} = {113}^{\circ}C
$$
已知原料液中易挥发组分的摩尔分数 $x_F = 0.5$,汽化率为60%,即 $V/F = 0.6$,其中 $V$ 为汽化量,$F$ 为原料液量。因此,液化率为 $L/F = 1 - V/F = 0.4$。
步骤 2:计算相平衡关系
根据相平衡关系,我们有:
$$
\dfrac{L}{F} = 1 - \dfrac{V}{F} = 0.4
$$
$$
\dfrac{V}{F} = 0.6
$$
因此,相平衡关系的斜率为:
$$
\dfrac{L}{V} = \dfrac{0.4}{0.6} = \dfrac{2}{3} = -0.667
$$
斜率为负值是因为气相中易挥发组分的摩尔分数 $y$ 高于液相中易挥发组分的摩尔分数 $x$。
步骤 3:确定气液相组成
在 x-y 图中,通过点 $e(0.5, 0.5)$ 作斜率为 $-0.667$ 的直线 $ef$,该直线与 x-y 平衡曲线的交点 $f$ 的坐标即为平衡的气液相组成。根据图示,可以得到:
$$
x \approx 0.387
$$
$$
y \approx 0.575
$$
步骤 4:确定平衡温度
根据 ${t}_{e}-x$ 曲线,从 $x = 0.387$ 可求得平衡温度:
$$
{t}_{e} = {113}^{\circ}C
$$