8题中已算出。因为最终转化率相同,故生产能力增加168、7/16、02=10、53倍。(2)二个300l釜并联,在最终转化率相同时,Q增加一倍,生产能力也增加一倍。 3.21 在反应体积为0.75 m3的全混流反应器中进行醋酐水解反应,进料体积流量为0.05 m3/min,醋酐浓度为0、22kmol/ m3,温度为25℃,出料温度为36℃,该反应为一级不可逆放热反应,反应热效应等于-209kJ/mol,反应速率常数与温度的关系如下:k=1、8×10-7 exp(-5526/T),min-1反应物料的密度为常数,等于1050kg/ m3,热容可按2、94kJ/kg、℃计算。该反应器没有安装换热器,仅通过反应器壁向大气散热。试计算:(1)(1) 反应器出口物料中醋酐的浓度;(2)(2) 单位时间内反应器向大气散出的热量。解:(1)(1) 求转化率:解得:XAf=0、8221反应器出口物料中醋酐浓度:(2)单位时间内反应器向大气散出的热量:3.22 在反应体积为1 m3的釜式反应器中,环氧丙烷的甲醇溶液与水反应生产丙二醇-1,2:该反应对环氧丙烷为一级,反应温度下反应速率常数等于0、98h-1,原料液中环氧丙烷的浓度为2、1kmol/m3,环氧丙烷的最终转化率为90%。(1)若采用间歇操作,辅助时间为0、65h,则丙二醇-1,2的日产量就是多少?(2)有人建议改在定态下连续操作,其余条件不变,则丙二醇-1,2的日产量又就是多少?(3)为什么这两种操作方式的产量会有不同?解:(1)(1) 一级不可逆反应:所以Q=0、109m3/h丙二醇的浓度=丙二醇的产量=(2) 采用定态下连续操作所以Q=0、109m3/h丙二醇的产量=(3)因连续釜在低的反应物浓度下操作,反映速率慢,故产量低。 3.23 根据习题3、11所规定的反应与数据,并假定反应过程中溶液密度恒定且等于1.02g/cm3,平均热容为4、186kJ/kg、K,忽略反应热随温度的变化,且为-2231kJ/kg乌洛托品,反应物料入口温度为25℃。问:(1)(1) 绝热温升就是多少?若采用绝热操作能否使转化率达到80%?操作温度为多少?(2)(2) 在100℃下等温操作,换热速率为多少?解:(1)绝热升温:
8题中已算出。因为最终转化率相同,故生产能力增加168、7/16、02=10、53倍。
(2)二个300l釜并联,在最终转化率相同时,Q增加一倍,生产能力也增加一倍。
3.21 在反应体积为0.75 m3的全混流反应器中进行醋酐水解反应,进料体积流量为0.05 m3/min,醋酐浓度为0、22kmol/ m3,温度为25℃,出料温度为36℃,该反应为一级不可逆放热反应,反应热效应等于-209kJ/mol,反应速率常数与温度的关系如下:
k=1、8×10-7 exp(-5526/T),min-1
反应物料的密度为常数,等于1050kg/ m3,热容可按2、94kJ/kg、℃计算。该反应器没有安装换热器,仅通过反应器壁向大气散热。试计算:
(1)(1) 反应器出口物料中醋酐的浓度;
(2)(2) 单位时间内反应器向大气散出的热量。
解:
(1)(1) 求转化率:
解得:XAf=0、8221
反应器出口物料中醋酐浓度:
(2)单位时间内反应器向大气散出的热量:
3.22 在反应体积为1 m3的釜式反应器中,环氧丙烷的甲醇溶液与水反应生产丙二醇-1,2:
该反应对环氧丙烷为一级,反应温度下反应速率常数等于0、98h-1,原料液中环氧丙烷的浓度为2、1kmol/m3,环氧丙烷的最终转化率为90%。
(1)若采用间歇操作,辅助时间为0、65h,则丙二醇-1,2的日产量就是多少?
(2)有人建议改在定态下连续操作,其余条件不变,则丙二醇-1,2的日产量又就是多少?
(3)为什么这两种操作方式的产量会有不同?
解:
(1)(1) 一级不可逆反应:
所以Q=0、109m3/h
丙二醇的浓度=
丙二醇的产量=
(2) 采用定态下连续操作
所以Q=0、109m3/h
丙二醇的产量=
(3)因连续釜在低的反应物浓度下操作,反映速率慢,故产量低。
3.23 根据习题3、11所规定的反应与数据,并假定反应过程中溶液密度恒定且等于1.02g/cm3,平均热容为4、186kJ/kg、K,忽略反应热随温度的变化,且为-2231kJ/kg乌洛托品,反应物料入口温度为25℃。问:
(1)(1) 绝热温升就是多少?若采用绝热操作能否使转化率达到80%?操作温度为多少?
(2)(2) 在100℃下等温操作,换热速率为多少?
解:
(1)绝热升温:
题目解答
答案
4在间歇反应器中,在绝热条件下进行液相反应:
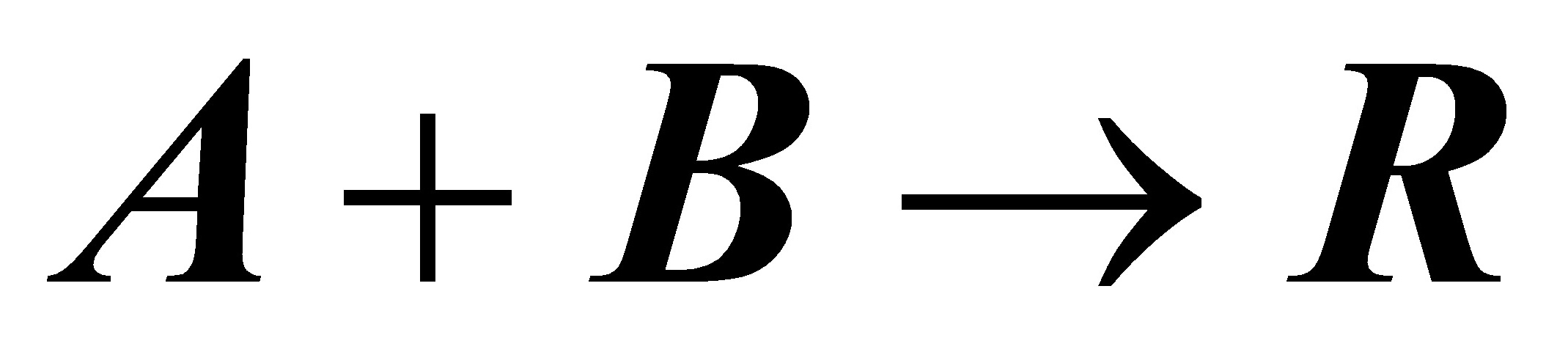
其反应速率方程为: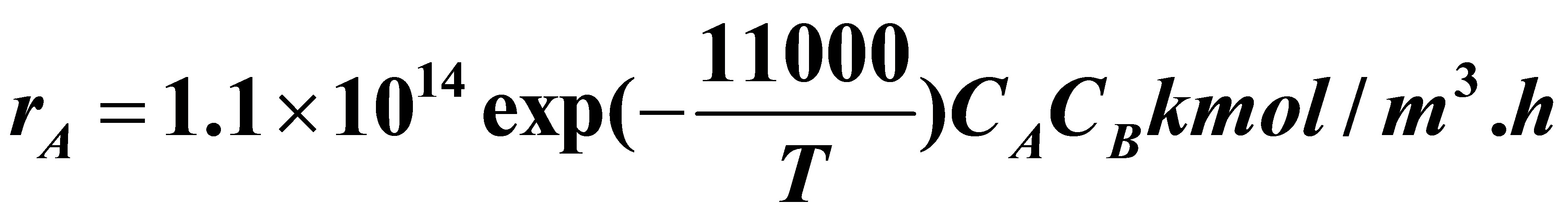
式中组分A及B的浓度CA及CB以kmol/m3为单位,温度T的单位为K。该反应的热效应等于-4000kJ/kmol。反应开始时溶液不含R,组分A与B的浓度均等于0、04kmol/m3,反应混合物的平均热容按4、102kJ/m3、K计算。反应开始时反应混合物的温度为50℃。
(1)(1) 试计算A的转化率达85%时所需的反应时间及此时的反应温度。
(2)(2) 如果要求全部反应物都转化为产物R,就是否可能?为什么?
解:(1)
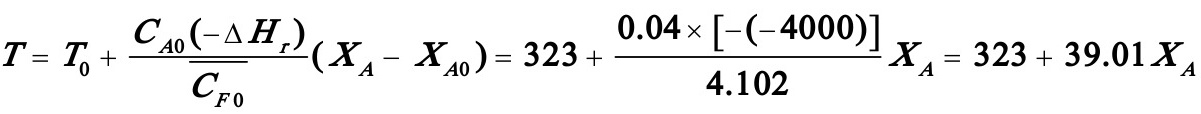
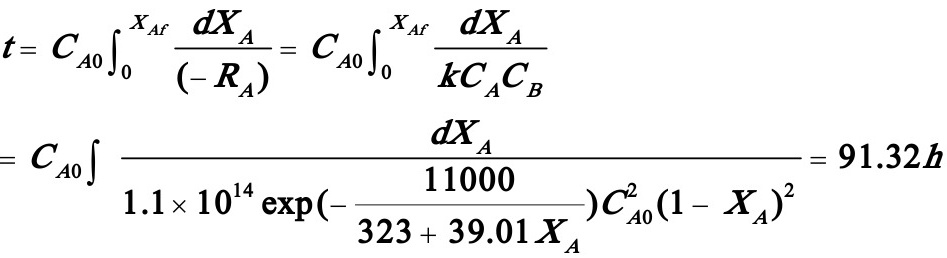
(由数值积分得出)
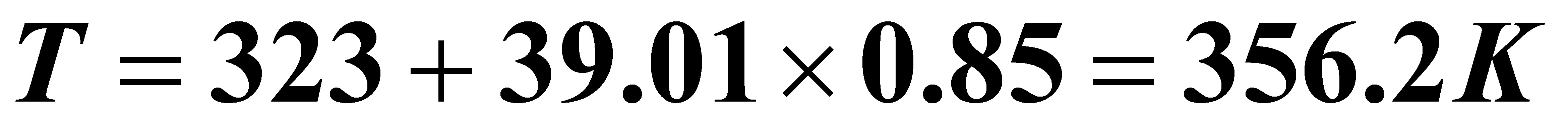
(2)若A全部转化为R,即XA=1、0,则由上面的积分式知,t→∝,这显然就是不可能的。