题目
氨合成塔入口的气体组成为3.5%NH3,20.8%N2,62.6%H2,7.08%Ar及5.89CH4。该塔是在30MPa压力下操作。已知催化剂床层中某处的温度为490℃,反应气体中氨含量为10%(mol),试计算该处的反应速率。在Fe催化剂上氨合成反应速率式为: =(k)_(1)P(x)_(2)P(P)_(2)(P)_({P)_(3)}-(k)_(2)P(N)_(2)(P)_({P)_(2)}^15kmol/(m)^3cdot h-|||-逆反应的活化能 overline (E)=17.58times (10)^4J/mol 。450℃时-|||-_(2)=2277(m)^3((MPa))^0.5/(m)^3cdot h ,且 _(1)ykparallel (k)_(2)=({k)_(P)}^2 ,490℃时,Kp可按下式计算:-|||-1 (rho )_(g)(R)_(0)=20049.817-2.49933008(T)^-1(1.256)^2+(1.856)^circ (10)^-3(T)^-2+3.206-|||-注:m^3为标准立方米。
氨合成塔入口的气体组成为3.5%NH3,20.8%N2,62.6%H2,7.08%Ar及5.89CH4。该塔是在30MPa压力下操作。已知催化剂床层中某处的温度为490℃,反应气体中氨含量为10%(mol),试计算该处的反应速率。在Fe催化剂上氨合成反应速率式为: 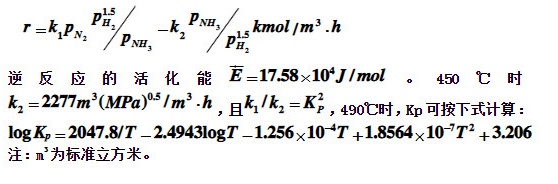
题目解答
答案

解析
考查要点:本题主要考查化学反应工程中的反应速率计算,涉及阿伦尼乌斯方程、平衡常数与速率常数的关系、分压计算及反应速率表达式的应用。
解题核心思路:
- 确定速率常数:利用阿伦尼乌斯方程计算490℃时的$k_2$,再通过$k_1 = k_2^2 K_p^2$求$k_1$。
- 计算分压:根据反应前后气体组成变化,结合总压计算各反应物、产物的分压。
- 代入速率式:将速率常数和分压代入速率方程,计算正、逆反应速率之差。
破题关键点:
- 温度对速率常数的影响:需通过阿伦尼乌斯方程修正$k_2$的温度依赖性。
- 平衡常数与速率常数的关系:利用$k_1$与$k_2$的关联式简化计算。
- 分压计算:需根据反应式调整各组分的摩尔分数,正确分配总压。
1. 计算490℃时的$k_2$
阿伦尼乌斯方程
$k_2 = A e^{-\frac{\overline{E}}{RT}}$
其中:
- $A = \frac{k2(450℃)}{e^{-\frac{\overline{E}}{R T{450}}}} = \frac{2277}{e^{-\frac{17.58 \times 10^4}{8.314 \times 450}}} \approx 3.145 \times 10^{16} \, \text{m}^3 \cdot \text{h}
$- 代入490℃:$
k_2(490℃) = 3.145 \times 10^{16} \cdot e^{-\frac{17.58 \times 10^4}{8.314 \times 490}} \approx 5.592 \times 10^{-2} \, \text{m}^3 \cdot \text{MPa}^{0.5} / (\text{m}^3 \cdot \text{h})
$### 2. 计算$k_1$ #### 平衡常数$K_p$ 根据题给公式计算得:$
\log K_p = -1.2524 \quad \Rightarrow \quad K_p = 10^{-1.2524} \approx 0.05592
$#### 关联$k_1$与$k_2$$
k_1 = k_2^2 \cdot K_p^2 = (5.592 \times 10^{-2})^2 \cdot (1.055 \times 10^4) \approx 33 \, \text{m}^3 \cdot \text{MPa}^{-1.5} / (\text{m}^3 \cdot \text{h})
$### 3. 计算分压 #### 反应式$
\frac{1}{2} \text{N}_2 + \frac{3}{2} \text{H}_2 \rightarrow \text{NH}3
$#### 摩尔分数调整 设转化率为$x_A$,根据物料平衡:$
y{\text{N}_2} = 0.2087 - 0.5xA, \quad y{\text{H}_2} = 0.626 - 1.5xA, \quad y{\text{NH}_3} = 0.035 + xA
$结合反应后氨含量$y_{\text{NH}_3} = 0.10$,解得$x_A \approx 0.1416$。 #### 分压计算 总压$P = 30 \, \text{MPa}$,各组分分压:$
P{\text{N}2} = 0.1904 \cdot 30 \approx 5.712 \, \text{MPa}, \quad P{\text{H}_2} = 0.5716 \cdot 30 \approx 17.148 \, \text{MPa}
$### 4. 代入速率方程$
r = k1 P{\text{N}2} P{\text{H}_2}^{1.5} - k2 P{\text{NH}_3}^{1.5}
$代入数据:$
r \approx 33 \cdot 5.712 \cdot 17.148^{1.5} - 5.592 \times 10^{-2} \cdot 10^{1.5} \approx 179.6 \, \text{kmol/m}^3 \cdot \text{h}
$$