一维势箱中粒子的零点能是________________________________C 11.由一维势箱的薛定谔方程求解结果所得量子数n,下面论述正确的是( )A.可取任一整数B.与势箱宽度一起决定节点数C.能量与n2成正比D.对应于可能的简并态B 12.下列函数中,,的共同本征函数是()。A cos kx B e–kxCsinxD(A)金属键(B)共价键(C)配位键(D)分子间力D8.六方晶系的特征元素是下列哪种旋转轴?(A)2次轴(B)3次轴(C)4次轴(D)6次轴A9.在晶体中,与坐标轴c垂直的晶面,其晶面指标是下列哪一个?(A)(001)(B)(010)(C)(100)(D)(111)C10.在下列各种晶体中,含有简单的独立分子的晶体是下列的哪种?(A)原子晶体(B)离子晶体(C)分子晶体(D)金属晶体C11.X射线衍射的方法是研究晶体微观结构的有效方法,其主要原因是由于下列的哪种?(A)X射线的粒子不带电(C)X射线的波长和晶体点阵面间距大致相当(B)X射线可使物质电离而便于检测(D)X射线的穿透能力强B12.一个离子具有下列哪一特性才能使附近其他离子极化或变形最大?(A)高的离子电荷和大的半径(B)高的离子电荷和小的半径(C)低的离子电荷和大的半径(D)低的离子电荷和小的半径C13.已知NaCl晶体属于立方面心点阵式,故其晶胞中含有的结构基元数为下列哪个数?(A)1(B)2(C)4(D)8C14.NaCl晶体的空间点阵型式是什么?(A)立方P(B)立方I(C)立方F(D)四方PD15.对于NaCl晶体的晶胞中所含的粒子,下列哪种说法是正确的?(A)一个Na+和一个Cl--(B)两个Na+和两个Cl--(C)三个Na+和三个Cl--(D)四个Na+和四个Cl--A16.用Bragg方程处理晶体对X射线的衍射问题,可将其看成下列的哪种现象?(A)晶面的反射(B)晶体的折射(C)电子的散射(D)晶体的吸收A17.Laue法可研究物质在什么状态下的结构?(A)固体(B)液体(C)气体(D)等离子体B18.在CsCl型晶体中,正离子的配位数是多少?(A)6(B)8(C)10(D)12B19.金刚石属立方晶系,每个晶胞所包括的C原子个数为下列哪个数?(A)4(B)8(C)12(D)16D20.某元素单质的晶体结构属于A1型立方面心结构,则该晶体的晶胞有多少个原子?(A)一个原子(B)两个原子(C)三个原子(D)四个原子C21.实验测得金属Ag属A1型密堆积,晶胞参数a=4.08×10-10m,金属Ag的原子半径为()。(A)0.72×10-10m(B)1.02×10-10m(C)1.44×10-10m(D)2.04×10-10mD22.在下列叙述中,哪个是正确的?(A)金属的离子半径和它的原子半径相同(B)金属的离子半径大于它的原子半径(C)非金属的离子半径和它的原子半径相同(D)金属的离子半径小于它的原子半径
一维势箱中粒子的零点能是________________________________
C 11.由一维势箱的薛定谔方程求解结果所得量子数n,下面论述正确的是( )
A.可取任一整数B.与势箱宽度一起决定节点数
C.能量与n2成正比D.对应于可能的简并态
B 12.下列函数中,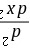 ,
,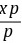 的共同本征函数是()。
的共同本征函数是()。
A cos kx B e–kxCsinxD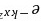
(A)金属键(B)共价键(C)配位键(D)分子间力
D8.六方晶系的特征元素是下列哪种旋转轴?
(A)2次轴(B)3次轴(C)4次轴(D)6次轴
A9.在晶体中,与坐标轴c垂直的晶面,其晶面指标是下列哪一个?
(A)(001)(B)(010)(C)(100)(D)(111)
C10.在下列各种晶体中,含有简单的独立分子的晶体是下列的哪种?
(A)原子晶体(B)离子晶体(C)分子晶体(D)金属晶体
C11.X射线衍射的方法是研究晶体微观结构的有效方法,其主要原因是由于下列的哪种?
(A)X射线的粒子不带电(C)X射线的波长和晶体点阵面间距大致相当
(B)X射线可使物质电离而便于检测(D)X射线的穿透能力强
B12.一个离子具有下列哪一特性才能使附近其他离子极化或变形最大?
(A)高的离子电荷和大的半径(B)高的离子电荷和小的半径
(C)低的离子电荷和大的半径(D)低的离子电荷和小的半径
C13.已知NaCl晶体属于立方面心点阵式,故其晶胞中含有的结构基元数为下列哪个数?
(A)1(B)2(C)4(D)8
C14.NaCl晶体的空间点阵型式是什么?
(A)立方P(B)立方I(C)立方F(D)四方P
D15.对于NaCl晶体的晶胞中所含的粒子,下列哪种说法是正确的?
(A)一个Na+和一个Cl--(B)两个Na+和两个Cl--
(C)三个Na+和三个Cl--(D)四个Na+和四个Cl--
A16.用Bragg方程处理晶体对X射线的衍射问题,可将其看成下列的哪种现象?
(A)晶面的反射(B)晶体的折射(C)电子的散射(D)晶体的吸收
A17.Laue法可研究物质在什么状态下的结构?
(A)固体(B)液体(C)气体(D)等离子体
B18.在CsCl型晶体中,正离子的配位数是多少?
(A)6(B)8(C)10(D)12
B19.金刚石属立方晶系,每个晶胞所包括的C原子个数为下列哪个数?
(A)4(B)8(C)12(D)16
D20.某元素单质的晶体结构属于A1型立方面心结构,则该晶体的晶胞有多少个原子?
(A)一个原子(B)两个原子(C)三个原子(D)四个原子
C21.实验测得金属Ag属A1型密堆积,晶胞参数a=4.08×10-10m,金属Ag的原子半径为()。
(A)0.72×10-10m(B)1.02×10-10m(C)1.44×10-10m(D)2.04×10-10m
D22.在下列叙述中,哪个是正确的?
(A)金属的离子半径和它的原子半径相同(B)金属的离子半径大于它的原子半径
(C)非金属的离子半径和它的原子半径相同(D)金属的离子半径小于它的原子半径
题目解答
答案
h 2 /8ml 2
解析
填空题(一维势箱零点能)
一维势箱中粒子的能量公式为 $E_n = \frac{n^2h^2}{8ml^2}$,其中 $n$ 为主量子数($n=1,2,3,\dots$)。零点能对应 $n=1$ 的最低能量,代入得 $E_1 = \frac{h^2}{8ml^2}$。
选择题解析
11. 一维势箱量子数 $n$ 的论述
- A. 可取任一整数:错误,$n$ 应为正整数($n=1,2,3,\dots$),而非“任一整数”(含零或负整数,无物理意义)。
- B. 与势箱宽度一起决定节点数:错误,节点数仅由 $n$ 决定:节点数 $= n-1$,与宽度无关。
- C. 能量与 $n^2$ 成正比:正确,能量公式 $E_n \propto n^2$。
- D. 对应于可能的简并态:错误,一维势箱能量能级非简并(每个 $n$ 对应唯一能量)。
12. $\frac{d}{dx}$ 的共同本征函数
本征函数需满足 $\hat{A}\psi = a\psi$($a$ 为常数)。
- A. $\cos kx$:$\frac{d}{dx}\cos kx = -k\sin kx \neq a\cos kx$,不是本征函数。
- B. $e^{-kx}$:$\frac{d}{dx}e^{-kx} = -ke^{-kx}$,满足本征函数条件(本征值 $-k$)。
- C. $\sin x$:$\frac{d}{dx}\sin x = \cos x \neq a\sin x$,不是本征函数。
- D. $e^{-y}-x^2$:含 $y$ 和 $x^2$,导数含 $-2x$,非常数倍,不是本征函数。
8. 六方晶系的特征元素
六方晶系的特征对称元素是 6次旋转轴(沿c轴),故选D。
f(x)=sinx是算符d²/dx²的本征函数,本征值是-1。
函数f(x)=e^0x是算符d/dx的本征函数,本征值是10。
在一个原子中,量子数n=3,l=1的轨道可以有3个,其电子的最大容量为6。
波函数ψ是用来描述微观粒子运动状态的数学表达式,它必须满足单值、连续、平方可积三个条件。
微观粒子的运动具有波粒二象性,其坐标和动量不能同时具有确定值,这称为不确定关系。
一维无限深方势阱中粒子的能量公式是En=n²h²/8ml决定,其中n=1,2,3,...,n=1时的能量称为零点能。
氢原子光谱的波数公式是~v=R(1/2²-1/n²),其中R称为里德伯常数。
在多电子原子中,电子的能量不仅与主量子数n有关,还与角量子数l有关。
s轨道的角度分布图形是球形对称的,p轨道的角度角度有极大值的方向是两个相反的方向。
分子轨道是由原子轨道线性组合而成的,成键分子轨道的能量比组合的原子轨道能量低,反键分子轨道的能量比组合的原子轨道能量高。
共价键的本质是原子轨道重叠,自旋相反的电子配对成键。
根据杂化轨道理论,BF3分子的空间构型是平面三角形,中心原子B采取sp2杂化。
NH3分子的空间构型是三角锥形,中心原子N采取sp3不等性杂化。
分子间力包括色散力、诱导力、取向力三种,其中色散力存在于一切分子之间。
氢键的形成条件是氢原子与电负性大、半径小的原子X以共价键结合,同时还能与另一个电负性大、半径小的原子Y形成氢键。
晶体的宏观对称性元素包括旋转轴、镜面、对称中心、反轴和旋转反伸轴五种。
在立方晶系中,晶面指标(111)表示D。
金属晶体的密堆积方式有面心立方堆积、六方密堆积和体心立方堆积三种,其中面心立方堆积和六方密堆积的配位数都是12。
X射线衍射的布拉格方程是2d sinθ=nλ,其中d是晶面间距,θ是入射线与晶面的夹角,n是衍射级数,λ是X射线波长。
配合物[Co(NH3)6]3+的中心离子是Co3+,配体是NH3,配位数是6。
配合物的价键理论认为,中心离子与配体之间的结合力是配位键,中心离子提供空轨道,配体提供孤对电子。
在酸性介质中,KMnO4与Fe2+反应的离子方程式是MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O。
在碱性介质中,Cl2与NaOH反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O。
原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置。
电解CuSO4溶液时,阳极的电极反应是4OH--4e-=2H2O+O2↑,阴极的电极反应是Cu2++2e-=Cu。
金属的电化学腐蚀分为吸氧腐蚀和析氢腐蚀两种,其中吸氧腐蚀更普遍。
化学反应速率随浓度变化的关系式称为速率方程,速率常数k的物理意义是反应物浓度均为1mol·L-1时的反应速率。
阿伦尼乌斯公式是k=Ae-Ea/RT,其中A称为指前因子,Ea称为活化能。
化学平衡的特征是正反应速率等于逆反应速率,各物质的浓度不再随时间变化。
吕·查德里原理指出,当体系达到平衡后,改变影响平衡的一个因素,平衡将向减弱这种改变的方向移动。
溶度积规则是判断沉淀生成和溶解的依据,当离子积Qc>Ksp时,有沉淀生成;当Qc<Ksp时,沉淀溶解。
缓冲溶液是由弱酸及其共轭碱或弱碱及其共轭酸组成的,其pH值计算公式是pH=pKa+lg[c(碱)/c(酸)]。
分析化学中,误差分为系统误差和偶然误差两种,系统误差影响测定结果的准确度,偶然误差影响测定结果的精密度。
滴定分析中,指示剂的选择原则是指示剂的变色范围全部或部分落在滴定突跃范围内。
在分光光度法中,吸光度A与浓度c的关系是A=εbc,其中ε称为摩尔吸光系数,b称为光程长度。
原子吸收光谱法的基本原理是待测元素的基态原子对其特征谱线的吸收,其定量分析方法主要有标准曲线法和标准加入法。
色谱法的基本原理是利用混合物中各组分在固定相和流动相之间的分配系数不同而实现分离的。
高效液相色谱法与气相色谱法的主要区别在于流动相的不同,前者用液体,后者用气体。
有机化合物的分类方法有按碳架分类、按官能团分类和按反应类型分类三种。
烷烃的通式是CnH2n+2,烯烃的通式是CnH2n,炔烃的通式是CnH2n-2。
甲烷的氯代反应是自由基链反应,包括链引发、链增长和链终止三个阶段。
烯烃的加成反应包括加氢、加卤化氢、加水和加卤素等,其中不对称烯烃与卤化氢的加成遵循马氏规则。
炔烃的特征反应是炔氢的酸性,可与强碱反应生成炔化物。
苯的结构特点是平面正六边形,碳碳键长完全相等,具有芳香性。
芳香烃的取代反应包括卤代、硝化、磺化和傅-克反应等,均遵循亲电取代机理。
醇的分类方法有按羟基所连碳原子的类型分为伯醇、仲醇和叔醇,按羟基数目分为一元醇、二元醇和多元醇。
醇的脱水反应有分子内脱水和分子间脱水两种,分子内脱水生成烯烃,分子间脱水生成醚。
酚的酸性比醇强,是因为酚羟基中的氧原子与苯环形成p-π共轭,使氧氢键极性增强。
醛和酮的官能团分别是醛基(-CHO)和酮基(>C=O),它们都能发生加成反应。
醛的特征反应是能发生银镜反应和与斐林试剂反应,酮则不能。
羧酸的官能团是羧基(-COOH),具有酸性,能与碱反应生成盐,与醇反应生成酯。
酯的水解反应是酯化反应的逆反应,在酸性或碱性条件下均可进行,碱性条件下的水解称为皂化反应。
胺的分类方法有按氨基数目分为一元胺、二元胺和多元胺,按烃基类型分为脂肪胺和芳香胺。
酰胺的官能团是酰胺基(-CONH2),可发生水解反应生成羧酸和胺。
糖的分类方法有按能否水解分为单糖、双糖和多糖,按羰基类型分为醛糖和酮糖。
葡萄糖的开链结构是己醛糖,环状结构是六元环(吡喃环),存在α和β两种构型。
蛋白质的基本组成单位是氨基酸,氨基酸的结构特点是分子中含有氨基和羧基。
核酸的基本组成单位是核苷酸,核苷酸由碱基、戊糖和磷酸组成。
石油的主要成分是烷烃、环烷烃和芳香烃,石油炼制的主要过程有蒸馏、裂化和重整等。
煤的干馏是将煤在隔绝空气的条件下加热分解的过程,可得到焦炭、煤焦油和煤气等产品。