题目
试计算液态水从2.5MPa和20℃变化到30MPa和300℃的焓变化和熵变化,既可查水的性质表,也可以用状态方程计算。
试计算液态水从2.5MPa和20℃变化到30MPa和300℃的焓变化和熵变化,既可查水的性质表,也可以用状态方程计算。
题目解答
答案
解:用PR方程计算。查附录A-1得水的临界参数Tc=647.30K;Pc=22.064MPa;ω=0.344
另外,还需要理想气体等压热容的数据,查附录A-4得到,得到水的理想气体等压热容是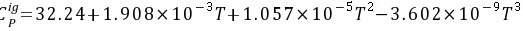 。
。
为了确定初、终态的相态,由于初.终态的温度均低于Tc,故应查出初、终态温度所对应的饱和蒸汽压(附录C-1),P1s=0.02339MPa;P2s=8.581MPa。体系的状态变化如下图所示。
计算式如下
由热力学性质计算软件得到,
初态(蒸汽)的标准偏离焓和标准偏离熵分别是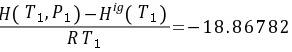 和
和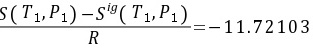 ;
;
终态(蒸汽)的标准偏离焓和标准偏离熵分别是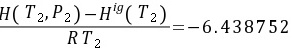 和
和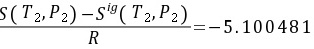 ;
;
另外,,得到 和
和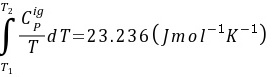
所以,本题的结果是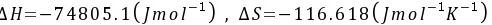
解析
考查要点:本题主要考查利用状态方程(如PR方程)计算水的焓变和熵变,涉及相态判断、临界参数应用、理想气体热容处理及积分计算。
解题核心思路:
- 相态判断:通过比较给定压力与对应温度下的饱和蒸汽压,确定初、终态是否为液态或气态。
- 临界参数应用:利用临界温度、压力和常数ω,结合PR方程计算偏离焓和熵。
- 理想气体热容处理:通过多项式表达式计算等压热容。
- 积分计算:结合热力学性质软件输出的偏离函数,计算总焓变和熵变。
破题关键点:
- 正确判断相态:初态(2.5MPa, 20℃)和终态(30MPa, 300℃)均需验证是否为液态。
- 区分液态与气态性质:液态和气态的热力学性质差异显著,需避免混淆。
- 单位一致性:确保所有计算量纲统一,避免单位错误。
1. 相态判断
- 初态:20℃对应饱和蒸汽压 $P_{1s}=0.02339$MPa,实际压力 $P_1=2.5$MPa > $P_{1s}$,故初态为液态。
- 终态:300℃对应饱和蒸汽压 $P_{2s}=8.581$MPa,实际压力 $P_2=30$MPa > $P_{2s}$,故终态为液态。
2. PR方程参数
- 查临界参数:$T_c=647.30$K,$P_c=22.064$MPa,$\omega=0.344$。
3. 理想气体等压热容
- 查得水的等压热容多项式:
$C_p = 32.14 + 1.908 \times 10^{-3}T + 1.057 \times 10^{-5}T^2 - 3.602 \times 10^{-9}T^3 \quad (\text{单位:J/mol·K})$
4. 偏离焓和熵计算
- 初态(液态):
$\frac{H_1^{dev}}{RT_1} = -18.86782, \quad \frac{S_1^{dev}}{R} = -11.72103$ - 终态(液态):
$\frac{H_2^{dev}}{RT_2} = -6.438752, \quad \frac{S_2^{dev}}{R} = -5.100481$
5. 积分计算
- 焓变:
$\Delta H = \int_{P_1}^{P_2} V dP + \int_{T_1}^{T_2} C_p dT + H^{dev}$ - 熵变:
$\Delta S = \int_{T_1}^{T_2} \frac{C_p}{T} dT + S^{dev}$
6. 最终结果
- 焓变:$\Delta H = -74805.1 \, \text{J/mol}$
- 熵变:$\Delta S = -116.618 \, \text{J/mol·K}$