题目
中国是世界上最早利用细菌冶金的国家。已知金属硫化物在“细菌氧化”时转化为硫酸盐,某工厂用细菌冶金技术处理载金硫化矿粉(其中细小的Au颗粒被FeS2、FeAsS包裹),以提高金的浸出率并冶炼金,工艺流程如:空气 NaCN溶液 Zn-|||-足量空气H2SO4 滤渣 Au-|||-浸出液-|||-、 浸金 含[Au(CN)2] 沉金-|||-矿粉一 细菌氧化 滤液②-|||-.=2 滤液① 沉铁砷 净化液-|||-含 ([ Zn{(CN))_(4)] }^2-回答下列问题:(1)北宋时期我国就有多处矿场利用细菌氧化形成的天然“胆水”冶炼铜,“胆水”的主要溶质为 ____ (填化学式)。(2)“细菌氧化”中,FeS2发生反应的离子方程式为 ____ 。(3)“沉铁砷”时需加碱调节pH,生成 ____ (填化学式)胶体起絮凝作用,促进了含As微粒的沉降。(4)“焙烧氧化”也可提高“浸金”效率,相比“焙烧氧化”,“细菌氧化”的优势为 ____ (填标号)。A.无需控温B.可减少有害气体产生C.设备无需耐高温D.不产生废液废渣(5)“真金不怕火炼”表明Au难被O2氧化,“浸金”中NaCN的作用为 ____ 。(6)“沉金”中Zn的作用为 ____ 。(7)滤液②经H2SO4酸化,[Zn(CN)4]2-转化为ZnSO4和HCN的化学方程式为 ____ 。用碱中和HCN可生成 ____ (填溶质化学式)溶液,从而实现循环利用。
中国是世界上最早利用细菌冶金的国家。已知金属硫化物在“细菌氧化”时转化为硫酸盐,某工厂用细菌冶金技术处理载金硫化矿粉(其中细小的Au颗粒被FeS2、FeAsS包裹),以提高金的浸出率并冶炼金,工艺流程如:
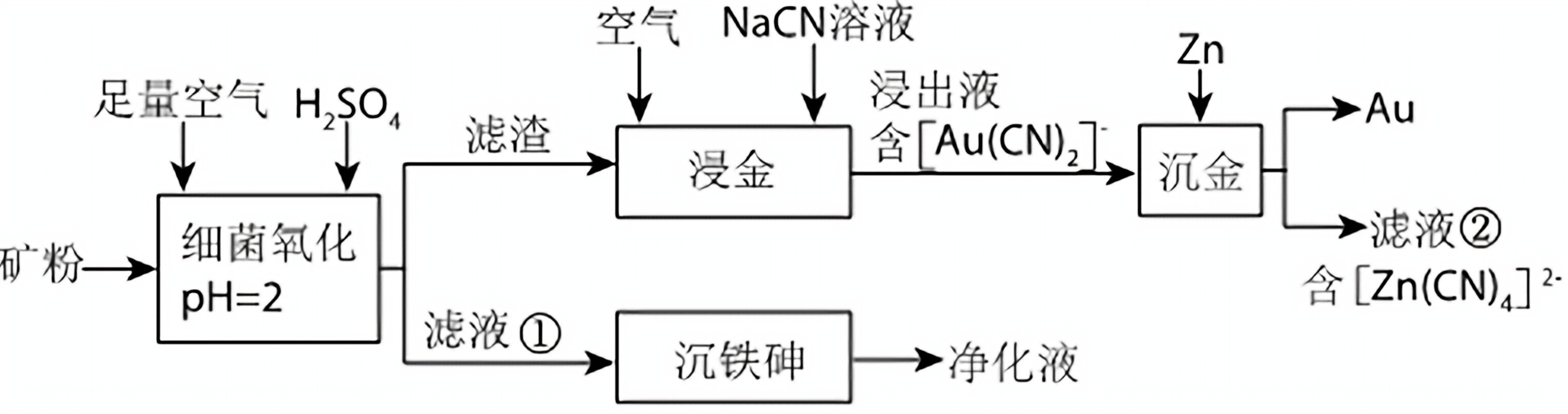
回答下列问题:
(1)北宋时期我国就有多处矿场利用细菌氧化形成的天然“胆水”冶炼铜,“胆水”的主要溶质为 ____ (填化学式)。
(2)“细菌氧化”中,FeS2发生反应的离子方程式为 ____ 。
(3)“沉铁砷”时需加碱调节pH,生成 ____ (填化学式)胶体起絮凝作用,促进了含As微粒的沉降。
(4)“焙烧氧化”也可提高“浸金”效率,相比“焙烧氧化”,“细菌氧化”的优势为 ____ (填标号)。
A.无需控温
B.可减少有害气体产生
C.设备无需耐高温
D.不产生废液废渣
(5)“真金不怕火炼”表明Au难被O2氧化,“浸金”中NaCN的作用为 ____ 。
(6)“沉金”中Zn的作用为 ____ 。
(7)滤液②经H2SO4酸化,[Zn(CN)4]2-转化为ZnSO4和HCN的化学方程式为 ____ 。用碱中和HCN可生成 ____ (填溶质化学式)溶液,从而实现循环利用。

回答下列问题:
(1)北宋时期我国就有多处矿场利用细菌氧化形成的天然“胆水”冶炼铜,“胆水”的主要溶质为 ____ (填化学式)。
(2)“细菌氧化”中,FeS2发生反应的离子方程式为 ____ 。
(3)“沉铁砷”时需加碱调节pH,生成 ____ (填化学式)胶体起絮凝作用,促进了含As微粒的沉降。
(4)“焙烧氧化”也可提高“浸金”效率,相比“焙烧氧化”,“细菌氧化”的优势为 ____ (填标号)。
A.无需控温
B.可减少有害气体产生
C.设备无需耐高温
D.不产生废液废渣
(5)“真金不怕火炼”表明Au难被O2氧化,“浸金”中NaCN的作用为 ____ 。
(6)“沉金”中Zn的作用为 ____ 。
(7)滤液②经H2SO4酸化,[Zn(CN)4]2-转化为ZnSO4和HCN的化学方程式为 ____ 。用碱中和HCN可生成 ____ (填溶质化学式)溶液,从而实现循环利用。
题目解答
答案
:(1)北宋时期我国就有多处矿场利用细菌氧化形成的天然“胆水”冶炼铜,“胆水”是硫酸铜溶液,主要溶质为:CuSO4,
故答案为:CuSO4;
(2)已知金属硫化物在“细菌氧化”时转化为硫酸盐,“细菌氧化”中,FeS2发生反应的离子方程式为:4FeS2+15O2+2H2O=4Fe3++4H++8${SO}_{4}^{2-}$,
故答案为:4FeS2+15O2+2H2O=4Fe3++4H++8${SO}_{4}^{2-}$;
(3))“沉铁砷”时需加碱调节pH,生成Fe(OH)3胶体起絮凝作用,促进了含As微粒的沉降,
故答案为:Fe(OH)3;
(4)“焙烧氧化”也可提高“浸金”效率,相比“焙烧氧化”,“细菌氧化”的优势为:可减少有害气体产生,设备无需耐高温,过程中细菌需要合适的温度,氧化过程中杂质在滤渣中,
故答案为:BC;
(5)NaCN促进金被氧气氧化生成稳定的[Au(CN)2]-,“浸金”中NaCN的作用为:助氧化剂,
故答案为:助氧化剂,促进金被氧化;
(6)“沉金”中Zn的作用为:还原剂,
故答案为:还原剂;
(7)滤液②经H2SO4酸化,[Zn(CN)4]2-转化为ZnSO4和HCN的化学方程式为:Na2[Zn(CN)4]+2H2SO4=ZnSO4+4HCN+Na2SO4,用碱中和HCN可生成NaCN溶液,从而实现循环利用,
故答案为:Na2[Zn(CN)4]+2H2SO4=ZnSO4+4HCN+Na2SO4;NaCN。
故答案为:CuSO4;
(2)已知金属硫化物在“细菌氧化”时转化为硫酸盐,“细菌氧化”中,FeS2发生反应的离子方程式为:4FeS2+15O2+2H2O=4Fe3++4H++8${SO}_{4}^{2-}$,
故答案为:4FeS2+15O2+2H2O=4Fe3++4H++8${SO}_{4}^{2-}$;
(3))“沉铁砷”时需加碱调节pH,生成Fe(OH)3胶体起絮凝作用,促进了含As微粒的沉降,
故答案为:Fe(OH)3;
(4)“焙烧氧化”也可提高“浸金”效率,相比“焙烧氧化”,“细菌氧化”的优势为:可减少有害气体产生,设备无需耐高温,过程中细菌需要合适的温度,氧化过程中杂质在滤渣中,
故答案为:BC;
(5)NaCN促进金被氧气氧化生成稳定的[Au(CN)2]-,“浸金”中NaCN的作用为:助氧化剂,
故答案为:助氧化剂,促进金被氧化;
(6)“沉金”中Zn的作用为:还原剂,
故答案为:还原剂;
(7)滤液②经H2SO4酸化,[Zn(CN)4]2-转化为ZnSO4和HCN的化学方程式为:Na2[Zn(CN)4]+2H2SO4=ZnSO4+4HCN+Na2SO4,用碱中和HCN可生成NaCN溶液,从而实现循环利用,
故答案为:Na2[Zn(CN)4]+2H2SO4=ZnSO4+4HCN+Na2SO4;NaCN。