题目
某氯化钾样品含有杂质氯化钙和氯化镁,实验室提纯流程如下:水 过量 过量-|||-KOH溶液 X溶液 过量盐酸-|||-KCl-|||-CaCl2 操作A 过滤 滤液 蒸发 KCl-|||-固体-|||-MgCl2 Mg(OH)2、CaCO3固体①操作A的目的是使样品 ____ .X溶液中溶质是 ____ .②过滤时用到的玻璃仪器有漏斗、 ____ .实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是 ____ .③本实验中蒸发是为了除去 ____ (填化学式).④若样品中含80g KCl,理论上最终所得KCl固体的质量 ____ (填编号).a.大于80g b.等于80g c.小于80g d.无法确定.
某氯化钾样品含有杂质氯化钙和氯化镁,实验室提纯流程如下:
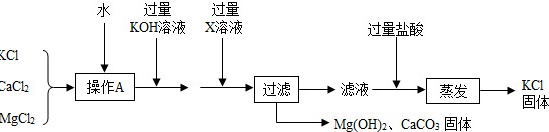
①操作A的目的是使样品 ____ .X溶液中溶质是 ____ .
②过滤时用到的玻璃仪器有漏斗、 ____ .实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是 ____ .
③本实验中蒸发是为了除去 ____ (填化学式).
④若样品中含80g KCl,理论上最终所得KCl固体的质量 ____ (填编号).
a.大于80g b.等于80g c.小于80g d.无法确定.

①操作A的目的是使样品 ____ .X溶液中溶质是 ____ .
②过滤时用到的玻璃仪器有漏斗、 ____ .实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是 ____ .
③本实验中蒸发是为了除去 ____ (填化学式).
④若样品中含80g KCl,理论上最终所得KCl固体的质量 ____ (填编号).
a.大于80g b.等于80g c.小于80g d.无法确定.
题目解答
答案
解:①加入水的目的是使样品充分溶解形成溶液,便于实验;根据流程图分析,加入氢氧化钾可以除去氯化镁,除去氯化钙而又不增加新的杂质用碳酸钾溶液;
故答案为:充分溶解;碳酸钾或K2CO3;
②过滤所用的玻璃仪器是烧杯、漏斗和玻璃棒;实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是滤纸没紧贴漏斗内壁,中间留有气泡或滤纸的规格不对等;
故答案为:烧杯、玻璃棒;滤纸没紧贴漏斗内壁,中间留有气泡(合理均可);
③蒸发可以除去溶液中的水分,而盐酸具有挥发性,可以挥发出氯化氢气体,所以同时还可以除去溶液中的氯化氢;故答案为:HCl、H2O;
④最后的氯化钾固体中包括了过量的碳酸钾、氢氧化钾和盐酸反应生成的氯化钾,还有氢氧化钾和氯化镁反应生成的氯化钾,所以最终所得氯化钾固体大于80g;
故选:a.
故答案为:充分溶解;碳酸钾或K2CO3;
②过滤所用的玻璃仪器是烧杯、漏斗和玻璃棒;实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是滤纸没紧贴漏斗内壁,中间留有气泡或滤纸的规格不对等;
故答案为:烧杯、玻璃棒;滤纸没紧贴漏斗内壁,中间留有气泡(合理均可);
③蒸发可以除去溶液中的水分,而盐酸具有挥发性,可以挥发出氯化氢气体,所以同时还可以除去溶液中的氯化氢;故答案为:HCl、H2O;
④最后的氯化钾固体中包括了过量的碳酸钾、氢氧化钾和盐酸反应生成的氯化钾,还有氢氧化钾和氯化镁反应生成的氯化钾,所以最终所得氯化钾固体大于80g;
故选:a.
解析
步骤 1:操作A的目的
操作A是将样品加入水中,目的是使样品充分溶解,形成溶液,便于后续的化学反应和分离。
步骤 2:X溶液中溶质的确定
X溶液用于除去氯化钙,而不引入新的杂质,因此X溶液中溶质应为碳酸钾(K_2CO_3),因为碳酸钾与氯化钙反应生成碳酸钙沉淀和氯化钾,不会引入新的杂质。
步骤 3:过滤时用到的玻璃仪器
过滤时用到的玻璃仪器包括漏斗、烧杯和玻璃棒。过滤速度较慢的原因可能是滤纸没紧贴漏斗内壁,中间留有气泡,或滤纸的规格不对。
步骤 4:蒸发的目的
蒸发是为了除去溶液中的水分(H_2O)和过量的盐酸(HCl),因为盐酸具有挥发性,可以随水分一起蒸发。
步骤 5:最终所得KCl固体的质量
最终所得KCl固体的质量大于80g,因为过量的碳酸钾、氢氧化钾和盐酸反应生成的氯化钾,以及氢氧化钾和氯化镁反应生成的氯化钾,都增加了最终氯化钾的质量。
操作A是将样品加入水中,目的是使样品充分溶解,形成溶液,便于后续的化学反应和分离。
步骤 2:X溶液中溶质的确定
X溶液用于除去氯化钙,而不引入新的杂质,因此X溶液中溶质应为碳酸钾(K_2CO_3),因为碳酸钾与氯化钙反应生成碳酸钙沉淀和氯化钾,不会引入新的杂质。
步骤 3:过滤时用到的玻璃仪器
过滤时用到的玻璃仪器包括漏斗、烧杯和玻璃棒。过滤速度较慢的原因可能是滤纸没紧贴漏斗内壁,中间留有气泡,或滤纸的规格不对。
步骤 4:蒸发的目的
蒸发是为了除去溶液中的水分(H_2O)和过量的盐酸(HCl),因为盐酸具有挥发性,可以随水分一起蒸发。
步骤 5:最终所得KCl固体的质量
最终所得KCl固体的质量大于80g,因为过量的碳酸钾、氢氧化钾和盐酸反应生成的氯化钾,以及氢氧化钾和氯化镁反应生成的氯化钾,都增加了最终氯化钾的质量。