题目
6.100g某硫酸溶液恰好与13g锌完全反应.请计算: (1)生成氢气的质量. (2)该稀硫酸溶液中溶质的质量分数.
6.100g某硫酸溶液恰好与13g锌完全反应.请计算:
(1)生成氢气的质量.
(2)该稀硫酸溶液中溶质的质量分数.
(1)生成氢气的质量.
(2)该稀硫酸溶液中溶质的质量分数.
题目解答
答案
分析 根据锌的质量结合方程式计算生成氢气的质量、稀硫酸溶液中溶质的质量质量,再依据溶质的质量分数计算即可.
解答 解:(1)设生成氢气的质量为x,稀硫酸溶液中溶质的质量为y
Zn+H 2 SO 4 =ZnSO 4 +H 2 ↑
6598 2
13gy x
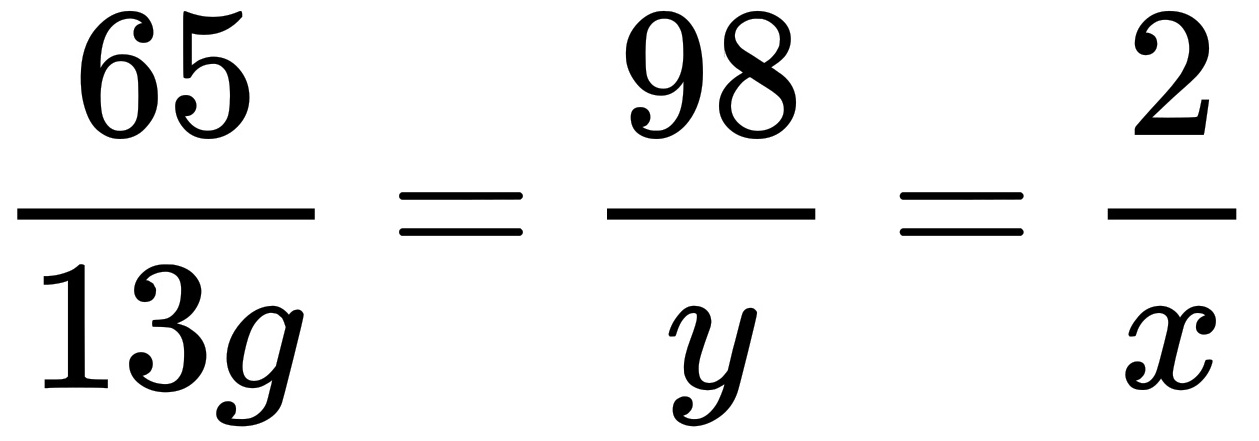 解得:x=0.4g y=19.6g
解得:x=0.4g y=19.6g
(2)该稀硫酸溶液中溶质的质量分数为: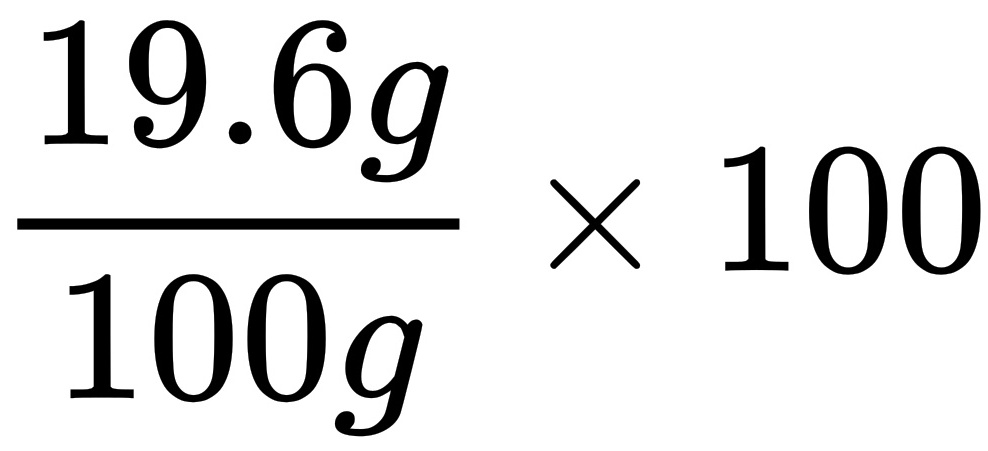 =19.6%.
=19.6%.
答:(1)生成氢气的质量为0.4g.(2)该稀硫酸溶液中溶质的质量分数为19.6%.
Zn+H 2 SO 4 =ZnSO 4 +H 2 ↑
6598 2
13gy x
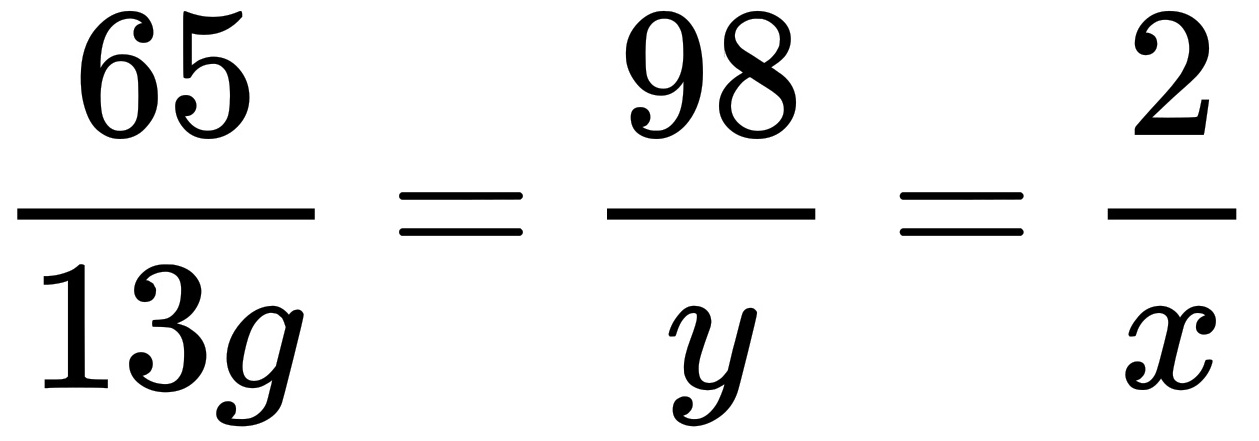 解得:x=0.4g y=19.6g
解得:x=0.4g y=19.6g(2)该稀硫酸溶液中溶质的质量分数为:
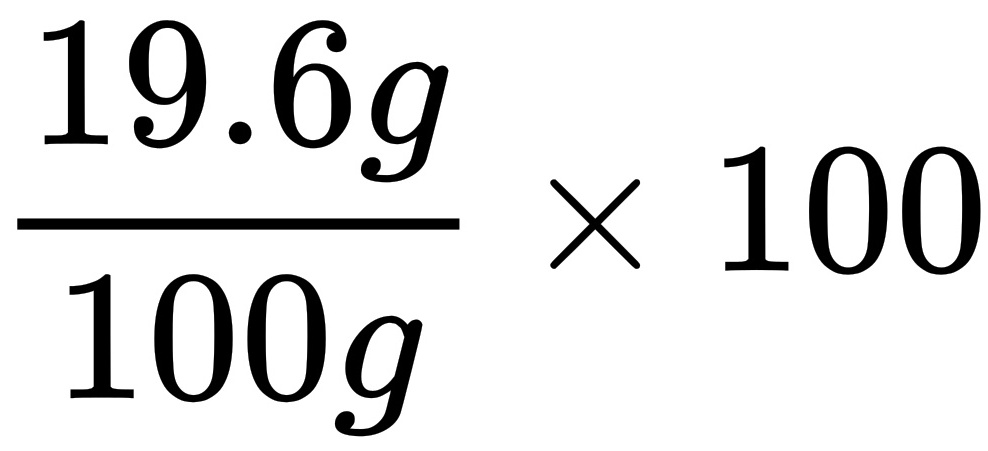 =19.6%.
=19.6%.答:(1)生成氢气的质量为0.4g.(2)该稀硫酸溶液中溶质的质量分数为19.6%.
点评 本题属于化学方程式的基本计算,注意计算的数据要准确.
解析
步骤 1:确定化学反应方程式
锌与硫酸反应的化学方程式为:Zn + H_2SO_4 → ZnSO_4 + H_2↑
步骤 2:计算生成氢气的质量
根据化学方程式,1摩尔的锌(Zn)与1摩尔的硫酸(H_2SO_4)反应生成1摩尔的硫酸锌(ZnSO_4)和1摩尔的氢气(H_2)。已知锌的摩尔质量为65g/mol,13g锌的摩尔数为13g / 65g/mol = 0.2mol。因此,生成的氢气的摩尔数也为0.2mol。氢气的摩尔质量为2g/mol,所以生成的氢气的质量为0.2mol × 2g/mol = 0.4g。
步骤 3:计算稀硫酸溶液中溶质的质量分数
根据化学方程式,1摩尔的锌与1摩尔的硫酸反应。已知锌的摩尔数为0.2mol,因此反应的硫酸的摩尔数也为0.2mol。硫酸的摩尔质量为98g/mol,所以反应的硫酸的质量为0.2mol × 98g/mol = 19.6g。稀硫酸溶液的质量为100g,因此稀硫酸溶液中溶质的质量分数为19.6g / 100g × 100% = 19.6%。
锌与硫酸反应的化学方程式为:Zn + H_2SO_4 → ZnSO_4 + H_2↑
步骤 2:计算生成氢气的质量
根据化学方程式,1摩尔的锌(Zn)与1摩尔的硫酸(H_2SO_4)反应生成1摩尔的硫酸锌(ZnSO_4)和1摩尔的氢气(H_2)。已知锌的摩尔质量为65g/mol,13g锌的摩尔数为13g / 65g/mol = 0.2mol。因此,生成的氢气的摩尔数也为0.2mol。氢气的摩尔质量为2g/mol,所以生成的氢气的质量为0.2mol × 2g/mol = 0.4g。
步骤 3:计算稀硫酸溶液中溶质的质量分数
根据化学方程式,1摩尔的锌与1摩尔的硫酸反应。已知锌的摩尔数为0.2mol,因此反应的硫酸的摩尔数也为0.2mol。硫酸的摩尔质量为98g/mol,所以反应的硫酸的质量为0.2mol × 98g/mol = 19.6g。稀硫酸溶液的质量为100g,因此稀硫酸溶液中溶质的质量分数为19.6g / 100g × 100% = 19.6%。