题目
用20℃的清水逆流吸收氨-空气混合气中的氨,已知混合气体温度为20℃,总压为101.3 kPa,其中氨的分压为1.0133 kPa,要求混合气体处理量为773m3/h,水吸收混合气中氨的吸收率为99%。在操作条件下物系的平衡关系为,若吸收剂用量为最小用的2倍,试求(1)塔每小时所需清水的量为多少kg?(2)塔底液相浓度(用摩尔分数表示)。
用20℃的清水逆流吸收氨-空气混合气中的氨,已知混合气体温度为20℃,总压为101.3 kPa,其中氨的分压为1.0133 kPa,要求混合气体处理量为773m3/h,水吸收混合气中氨的吸收率为99%。在操作条件下物系的平衡关系为,若吸收剂用量为最小用的2倍,试求(1)塔每小时所需清水的量为多少kg?(2)塔底液相浓度(用摩尔分数表示)。
题目解答
答案
解:
(1) 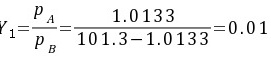
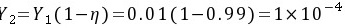
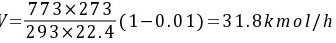
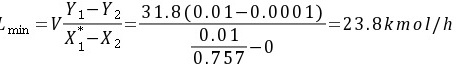
实际吸收剂用量L=2Lmin=2×23.8=47.6kmol/h
=856.8 kg/h
(2) X1 = X2+V(Y1-Y2)/L=0+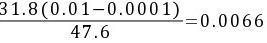
解析
步骤 1:计算混合气体中氨的摩尔分数
根据题意,混合气体中氨的分压为1.0133 kPa,总压为101.3 kPa,因此氨的摩尔分数为:
${Y}_{1}=\dfrac {{P}_{A}}{{P}_{B}}=\dfrac {1.0133}{101.3-1.0133}=0.01$.
步骤 2:计算吸收后氨的摩尔分数
根据题意,吸收率为99%,因此吸收后氨的摩尔分数为:
${Y}_{2}={Y}_{1}(1-n)=0.01(1-0.99)=1\times {10}^{-4}$
步骤 3:计算混合气体的摩尔流量
根据理想气体状态方程,混合气体的摩尔流量为:
$y=\dfrac {773\times 273}{293\times 22.4}(1-0.01)=31.8kmol/h$
步骤 4:计算吸收剂的摩尔流量
根据题意,吸收剂用量为最小用量的2倍,最小用量为:
$L_{min}=\dfrac {V(Y_{1}-Y_{2})}{Y_{1}}=\dfrac {31.8(0.01-0.0001)}{0.01}=31.5kmol/h$
因此,实际吸收剂用量为:
$L=2L_{min}=2\times 31.5=63kmol/h$
步骤 5:计算塔底液相浓度
根据物料平衡,塔底液相浓度为:
$X_{1}=X_{2}+\dfrac {V(Y_{1}-Y_{2})}{L}=0+\dfrac {31.8(0.01-0.0001)}{63}=0.005$
根据题意,混合气体中氨的分压为1.0133 kPa,总压为101.3 kPa,因此氨的摩尔分数为:
${Y}_{1}=\dfrac {{P}_{A}}{{P}_{B}}=\dfrac {1.0133}{101.3-1.0133}=0.01$.
步骤 2:计算吸收后氨的摩尔分数
根据题意,吸收率为99%,因此吸收后氨的摩尔分数为:
${Y}_{2}={Y}_{1}(1-n)=0.01(1-0.99)=1\times {10}^{-4}$
步骤 3:计算混合气体的摩尔流量
根据理想气体状态方程,混合气体的摩尔流量为:
$y=\dfrac {773\times 273}{293\times 22.4}(1-0.01)=31.8kmol/h$
步骤 4:计算吸收剂的摩尔流量
根据题意,吸收剂用量为最小用量的2倍,最小用量为:
$L_{min}=\dfrac {V(Y_{1}-Y_{2})}{Y_{1}}=\dfrac {31.8(0.01-0.0001)}{0.01}=31.5kmol/h$
因此,实际吸收剂用量为:
$L=2L_{min}=2\times 31.5=63kmol/h$
步骤 5:计算塔底液相浓度
根据物料平衡,塔底液相浓度为:
$X_{1}=X_{2}+\dfrac {V(Y_{1}-Y_{2})}{L}=0+\dfrac {31.8(0.01-0.0001)}{63}=0.005$