题目
利用金属Al、海水及其中的溶解氧可组成电池,如图所示。下列说法正确的是( )A. b电极为电池正极B. 电池工作时,海水中的Na+向a电极移动C. 电池工作时,紧邻a电极区域的海水呈强碱性D. 每消耗1kgAl,电池最多向外提供37mol电子的电量
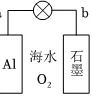 利用金属Al、海水及其中的溶解氧可组成电池,如图所示。下列说法正确的是( )
利用金属Al、海水及其中的溶解氧可组成电池,如图所示。下列说法正确的是( )- A. b电极为电池正极
- B. 电池工作时,海水中的Na+向a电极移动
- C. 电池工作时,紧邻a电极区域的海水呈强碱性
- D. 每消耗1kgAl,电池最多向外提供37mol电子的电量
题目解答
答案
A. b电极为电池正极
解析
本题考查原电池的工作原理,涉及金属铝在海水中的电化学反应。解题核心在于判断正负极、离子移动方向及电极反应产物。关键点包括:
- 铝作为活泼金属,通常为负极,发生氧化反应;
- 正极反应为溶解氧的还原,生成OH⁻;
- 阳离子向正极迁移;
- 电子转移量需根据铝的摩尔数计算。
选项分析
A. b电极为电池正极
铝为负极(a电极),氧气参与反应的b电极为正极。正极反应为:
$\text{O}_2 + 2\text{H}_2\text{O} + 4\text{e}^- \rightarrow 4\text{OH}^-$
结论正确。
B. 海水中的Na⁺向a电极移动
原电池中阳离子(Na⁺)应迁向正极(b电极),而非负极(a电极)。结论错误。
C. 紧邻a电极区域的海水呈强碱性
铝在负极反应生成Al³⁺:
$\text{Al} \rightarrow \text{Al}^{3+} + 3\text{e}^-$
Al³⁺与OH⁻结合形成Al(OH)₃沉淀,导致局部pH变化不显著,不会呈现强碱性。结论错误。
D. 每消耗1kg Al提供37mol电子
铝摩尔数为:
$\frac{1000}{27} \approx 37.04 \, \text{mol}$
每mol铝释放3mol电子,总电子数为:
$37.04 \times 3 \approx 111.11 \, \text{mol}$
选项中“37mol”仅为铝的摩尔数,未乘以3,结论错误。