题目
已知A(g)+B(s)=c(g)+D(s) △1.H^θ=-52.99kJ-|||-__ 298K,100kPa下发生反应,体系做了最大功并放热1.49kJ.试求反应过程的△1.H^θ=-52.99kJ-|||-__。
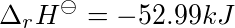 298K,100kPa下发生反应,体系做了最大功并放热1.49kJ.试求反应过程的
298K,100kPa下发生反应,体系做了最大功并放热1.49kJ.试求反应过程的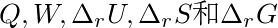 。
。
题目解答
答案
1.49kJ;51.5kJ;-52.99kJ;
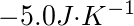 ;
-51.5kJ
;
-51.5kJ
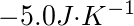 ;
-51.5kJ
;
-51.5kJ解析
步骤 1:确定反应的热力学参数
根据题目,已知反应的焓变 $\Delta _{r}H^{\ominus}=-52.99kJ$,反应在298K,100kPa下进行,体系做了最大功并放热1.49kJ。根据热力学第一定律,体系的内能变化 $\Delta _{r}U$ 可以通过焓变和功来计算。
步骤 2:计算体系的内能变化 $\Delta _{r}U$
根据热力学第一定律,$\Delta _{r}U = Q + W$,其中Q是体系放出的热量,W是体系做的功。题目中给出Q=-1.49kJ(负号表示放热),W=-51.5kJ(负号表示体系对外做功)。因此,$\Delta _{r}U = -1.49kJ - 51.5kJ = -52.99kJ$。
步骤 3:计算反应的熵变 $\Delta _{r}S$
根据热力学第二定律,$\Delta _{r}G = \Delta _{r}H - T\Delta _{r}S$,其中$\Delta _{r}G$是吉布斯自由能变化,$\Delta _{r}H$是焓变,T是温度,$\Delta _{r}S$是熵变。题目中给出$\Delta _{r}H = -52.99kJ$,$\Delta _{r}G = -51.5kJ$,T=298K。因此,$\Delta _{r}S = (\Delta _{r}H - \Delta _{r}G) / T = (-52.99kJ + 51.5kJ) / 298K = -5.0J·K^{-1}$。
步骤 4:计算反应的吉布斯自由能变化 $\Delta _{r}G$
根据热力学第二定律,$\Delta _{r}G = \Delta _{r}H - T\Delta _{r}S$。题目中给出$\Delta _{r}H = -52.99kJ$,$\Delta _{r}S = -5.0J·K^{-1}$,T=298K。因此,$\Delta _{r}G = -52.99kJ - 298K \times (-5.0J·K^{-1}) = -51.5kJ$。
根据题目,已知反应的焓变 $\Delta _{r}H^{\ominus}=-52.99kJ$,反应在298K,100kPa下进行,体系做了最大功并放热1.49kJ。根据热力学第一定律,体系的内能变化 $\Delta _{r}U$ 可以通过焓变和功来计算。
步骤 2:计算体系的内能变化 $\Delta _{r}U$
根据热力学第一定律,$\Delta _{r}U = Q + W$,其中Q是体系放出的热量,W是体系做的功。题目中给出Q=-1.49kJ(负号表示放热),W=-51.5kJ(负号表示体系对外做功)。因此,$\Delta _{r}U = -1.49kJ - 51.5kJ = -52.99kJ$。
步骤 3:计算反应的熵变 $\Delta _{r}S$
根据热力学第二定律,$\Delta _{r}G = \Delta _{r}H - T\Delta _{r}S$,其中$\Delta _{r}G$是吉布斯自由能变化,$\Delta _{r}H$是焓变,T是温度,$\Delta _{r}S$是熵变。题目中给出$\Delta _{r}H = -52.99kJ$,$\Delta _{r}G = -51.5kJ$,T=298K。因此,$\Delta _{r}S = (\Delta _{r}H - \Delta _{r}G) / T = (-52.99kJ + 51.5kJ) / 298K = -5.0J·K^{-1}$。
步骤 4:计算反应的吉布斯自由能变化 $\Delta _{r}G$
根据热力学第二定律,$\Delta _{r}G = \Delta _{r}H - T\Delta _{r}S$。题目中给出$\Delta _{r}H = -52.99kJ$,$\Delta _{r}S = -5.0J·K^{-1}$,T=298K。因此,$\Delta _{r}G = -52.99kJ - 298K \times (-5.0J·K^{-1}) = -51.5kJ$。