题目
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,受热易分解。亚氯酸钠制备及部分性质实验如下:H2O2(aq)-|||-(O)_(2)(g) 一 反应I →NaClO2(aq) 结晶 NaClO2(s) 加热 固体A 稀硫酸 →黄绿色气体-|||-隔绝空气 (2.715g) 反应Ⅱ-|||-NaOH(aq) 水溶解-|||-溶液 稀硝酸 (1.435g)-|||-足量AgNO3(aq) 白色沉淀已知:①固体A为两种含氯盐组成的混合物:②AgClO3和AgcClO4都溶于水。请回答:(1)双氧水的电子式为 ____ ,固体A的成分是 ____ (用化学式表示)。(2)反应I的离子方程式为 ____ 。(3)反应Ⅱ的化学方程式为 ____ 。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,受热易分解。亚氯酸钠制备及部分性质实验如下:
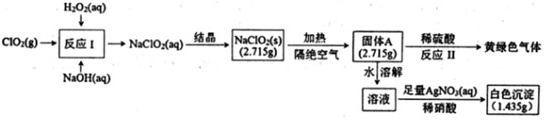
已知:①固体A为两种含氯盐组成的混合物:②AgClO3和AgcClO4都溶于水。
请回答:
(1)双氧水的电子式为 ____ ,固体A的成分是 ____ (用化学式表示)。
(2)反应I的离子方程式为 ____ 。
(3)反应Ⅱ的化学方程式为 ____ 。

已知:①固体A为两种含氯盐组成的混合物:②AgClO3和AgcClO4都溶于水。
请回答:
(1)双氧水的电子式为 ____ ,固体A的成分是 ____ (用化学式表示)。
(2)反应I的离子方程式为 ____ 。
(3)反应Ⅱ的化学方程式为 ____ 。
题目解答
答案
解:(1)双氧水的结构式为H-O-O-H,电子式为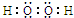 ,固体A为 NaCl、NaClO3,
,固体A为 NaCl、NaClO3,
故答案为: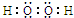 ;NaCl、NaClO3;
;NaCl、NaClO3;
(2)反应I的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)反应Ⅱ的化学方程式为NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O,
故答案为:NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O。
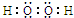 ,固体A为 NaCl、NaClO3,
,固体A为 NaCl、NaClO3,故答案为:
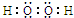 ;NaCl、NaClO3;
;NaCl、NaClO3;(2)反应I的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)反应Ⅱ的化学方程式为NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O,
故答案为:NaClO3+5NaCl+3H2SO4=3Na2SO4+3Cl2↑+3H2O。
解析
- 双氧水的电子式:考查常见分子的电子式书写,需注意氧原子的孤对电子和共价键的表示。
- 固体A的成分:根据反应条件和后续实验现象(如加热分解产生黄绿色气体),推断涉及Cl的歧化反应,生成NaCl和NaClO₃。
- 反应方程式:
- 反应I:ClO₂与H₂O₂在碱性条件下的氧化还原反应,需配平Cl和O的氧化态变化。
- 反应II:NaClO₃与NaCl在酸性条件下的归中反应,生成Cl₂。
第(1)题
双氧水的电子式
双氧水(H₂O₂)中,每个O原子通过共价键与两个H原子和一个O原子相连。电子式需体现O的孤对电子和共价键:
$\text{H:O:O:H}$
固体A的成分
- 反应条件:亚氯酸钠(NaClO₂)受热分解。
- 实验现象:加热固体A后,与稀硫酸反应生成黄绿色气体(Cl₂),说明分解产物含NaClO₃(不稳定,分解生成Cl₂)。
- 推断:NaClO₂分解发生Cl的歧化反应,生成NaCl(Cl⁻)和NaClO₃(ClO₃⁻)。
第(2)题
反应物与产物分析
- ClO₂(Cl +4价)转化为ClO₂⁻(Cl +3价),被还原。
- H₂O₂分解生成O₂(O -1→0价),被氧化。
- 配平:根据电子转移守恒,ClO₂得1e⁻,H₂O₂失2e⁻,最小公倍数为2,得:
$2\text{ClO}_2 + \text{H}_2\text{O}_2 + 2\text{OH}^- \rightarrow 2\text{ClO}_2^- + \text{O}_2↑ + 2\text{H}_2\text{O}$
第(3)题
反应条件与产物
- NaClO₃与NaCl在酸性条件下发生归中反应,生成Cl₂:
$\text{NaClO}_3 + 5\text{NaCl} + 3\text{H}_2\text{SO}_4 \rightarrow 3\text{Na}_2\text{SO}_4 + 3\text{Cl}_2↑ + 3\text{H}_2\text{O}$ - 配平:ClO₃⁻与Cl⁻按1:5比例反应,生成3Cl₂。