题目
8.已知 '((O)_(2)/OH)=0.401V, ^theta ((S)(S))=-0.48V _(sp)^theta ((Ag)_(2)S)=-|||-.3times (10)^-50, _(P)[ Ag((CN))_(2)] =1.3times (10)^21 在空气存在下将A g2S溶解在NaCN-|||-溶液中,反应生成A g(CN)2和单质硫。(1)写出相应反应的离子方程式;-|||-(2)计算25℃时该反应的标准平衡常数。

题目解答
答案
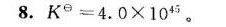
解析
步骤 1:写出反应的离子方程式
在空气存在下,将$Ag_2S$溶解在$NaCN$溶液中,反应生成$Ag(CN)_2$和单质硫。反应的离子方程式为:
$$
Ag_2S + 4CN^- \rightarrow 2Ag(CN)_2^- + S
$$
步骤 2:计算反应的标准平衡常数
反应的标准平衡常数$K$可以通过反应物和生成物的标准平衡常数计算。已知$K_{sp}^{\theta}(Ag_2S) = 6.3 \times 10^{-50}$和$K_{P}[Ag(CN)_2] = 1.3 \times 10^{21}$,则反应的标准平衡常数$K$为:
$$
K = \frac{[Ag(CN)_2^-]^2}{[Ag_2S][CN^-]^4}
$$
由于$Ag_2S$的溶解度很小,可以忽略其浓度,因此$K$可以简化为:
$$
K = \frac{[Ag(CN)_2^-]^2}{[CN^-]^4} = \frac{K_{P}[Ag(CN)_2]^2}{K_{sp}^{\theta}(Ag_2S)}
$$
将已知的$K_{P}[Ag(CN)_2]$和$K_{sp}^{\theta}(Ag_2S)$代入上式,得到:
$$
K = \frac{(1.3 \times 10^{21})^2}{6.3 \times 10^{-50}} = 4.0 \times 10^{45}
$$
在空气存在下,将$Ag_2S$溶解在$NaCN$溶液中,反应生成$Ag(CN)_2$和单质硫。反应的离子方程式为:
$$
Ag_2S + 4CN^- \rightarrow 2Ag(CN)_2^- + S
$$
步骤 2:计算反应的标准平衡常数
反应的标准平衡常数$K$可以通过反应物和生成物的标准平衡常数计算。已知$K_{sp}^{\theta}(Ag_2S) = 6.3 \times 10^{-50}$和$K_{P}[Ag(CN)_2] = 1.3 \times 10^{21}$,则反应的标准平衡常数$K$为:
$$
K = \frac{[Ag(CN)_2^-]^2}{[Ag_2S][CN^-]^4}
$$
由于$Ag_2S$的溶解度很小,可以忽略其浓度,因此$K$可以简化为:
$$
K = \frac{[Ag(CN)_2^-]^2}{[CN^-]^4} = \frac{K_{P}[Ag(CN)_2]^2}{K_{sp}^{\theta}(Ag_2S)}
$$
将已知的$K_{P}[Ag(CN)_2]$和$K_{sp}^{\theta}(Ag_2S)$代入上式,得到:
$$
K = \frac{(1.3 \times 10^{21})^2}{6.3 \times 10^{-50}} = 4.0 \times 10^{45}
$$