题目
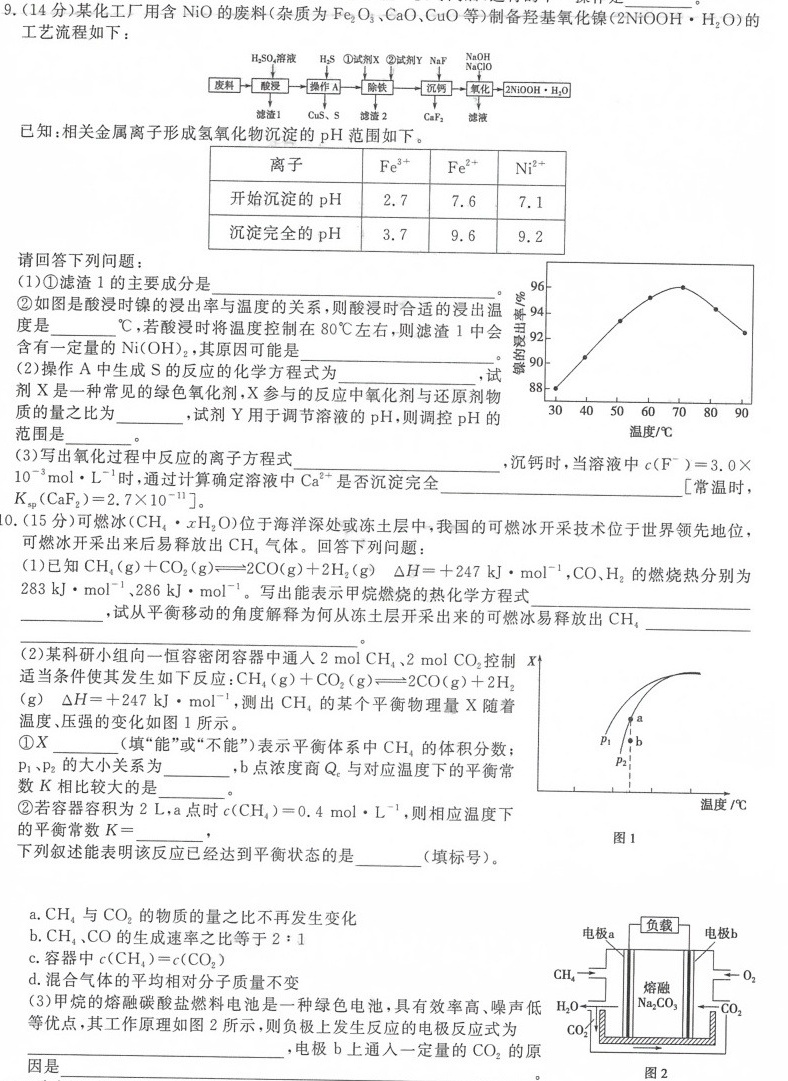
9.(14分)某化工厂用含NiO的废料(杂质为Fe2 O3、CaO、CuO等)制备羟基氧化镍(2NiOOH·H 2O)的-|||-__-|||-工艺流程如下:-|||-SO4溶液 H2S ①试剂X②试剂Y NaF NaClO-|||-NaOH-|||-废料 酸浸 操作A 除铁 沉钙 氧化 2NiOOH·H2O-|||-滤渣1 CuS、S 滤渣2 CaF2 滤液-|||-知:相关金属离子形成氢氧化物沉淀的pH范围如下。-|||-离子 (e)^3+ (e)^2+ (N{F)_(1)}^2+-|||-开始沉淀的pH 2.7 7.6 7.1-|||-沉淀完全的pH 3.7 9.6 9.2-|||-请回答下列问题:-|||-(1)①滤渣1的主要成分是 __-|||-②如图是酸浸时镍的浸出率与温度的关系,则酸浸时合适的浸出温-|||-度是 __ ℃,若酸浸时将温度控制在80℃左右,则滤渣1中会-|||-含有一定量的Ni(OH)2,其原因可能是 __-|||-例94 96-|||-92-|||-90-|||-88-|||-30 40 50 60 70 80 90-|||-温度/℃-|||-(2)操作A中生成S的反应的化学方程式为 __ ,试-|||-剂X是一种常见的绿色氧化剂,X参与的反应中氧化剂与还原剂物-|||-质的量之比为 __ 试剂Y用于调节溶液的pH,则调控pH的-|||-范围是 __-|||-(3)写出氧化过程中反应的离子方程式 __ 沉钙时,当溶液中 ((F)^-)=3.0times -|||-^-3molcdot (L)^-1 时,通过计算确定溶液中 (a)^2+ 是否沉淀完全 __ 常温时,-|||-_(sp)(Ca(F)_(2))=2.7times (10)^-11] -|||-0.(15分)可燃冰(CH4·xH2O)位于海洋深处或冻土层中,我国的可燃冰开采技术位于世界领先地位,-|||-可燃冰开采出来后易释放出CH4气体。回答下列问题:-|||-(1)已知CH2(g)+CO2(g)=2CO(g)2H2(g) △H=+247 kJ·mol^(-1),CO、H2的燃烧热分别为-|||-283kJ·ma(1-286kJ·mol^(-1)出能表示甲烷燃烧的热化学方程式 __-|||-__ 试从平衡移动的角度解释为何从冻土层开采出来的可燃冰易释放出CH4 __-|||-__-|||-(2)某科研小组向一恒容密闭容器中通入2molCH42 molCO2控制 xt-|||-适当条件使其发生如下反应: (H)_(4)(g)+C(O)_(2)(g)leftharpoons 2CO(g)+2(H)_(2)-|||-(g) Delta H=2+7kJcdot mo(l)^-1, 测出CH4的某个平衡物理量X随着-|||-温度、压强的变化如图1所示。-|||-pì-|||-温度/℃-|||-图1-|||-①X __ 填"能"或"不能")表示平衡体系中CH4的体积分数;-|||-p1、p2的大小关系为 __ 点浓度商Q,与对应温度下的平衡常-|||-数K相比较大的是 __-|||-②若容器容积为2L,a点时 (C(H)_(4))=0.4molcdot (L)^-1, 则相应温度下-|||-的平衡常数 = __ ,-|||-下列叙述能表明该反应已经达到平衡状态的是 __ 填标号)。-|||-a.CH4与CO2的物质的量之比不再发生变化-|||-b.CH4,CO的生成速率之比等于2:1-|||-c.容器中 (C(H)_(4))=c(C(O)_(2))-|||-d.混合气体的平均相对分子质量不变-|||-电极a 负载 电极b-|||-CH4 -O2-|||-熔融-|||-H2O- 2α03 CO2-|||-CO2-|||-图2-|||-(3)甲烷的熔融碳酸盐燃料电池是一种绿色电池,具有效率高、噪声低-|||-等优点,其工作原理如图2所示,则负极上发生反应的电极反应式为-|||-__ 电极b上通入一定量的CO2的原-|||-因是 __
题目解答
答案
