题目
某小组以KMnO4和草酸(H2C2O4)的实验研究化学反应速率的影响因素,反应原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2OⅠ.甲小组设计如下实验方案探究反应物浓度和溶液酸性对速率的影响:【限选试剂和仪器】0.5mol⋅L−1H2C2O4溶液、0.05mol⋅L−1KMnO4溶液(末酸化)、5mol⋅L−1H2SO4溶液、试管、胶头滴管、秒表序号V(H2C2O4)/mLV(H2O)/mLV(KMnO4)/mLV(稀硫酸)/mLⅠ2.01.01.01.0Ⅱ1.02.0a1.0Ⅲ2.0b1.02.0(1)表中a= ,b= 。(2)为定量比较反应速率的快慢,本实验应测量 。(3)对比实验 和 (填序号)可探究溶液酸性对反应速率的影响。Ⅱ.乙小组利用色度传感器(检测溶液颜色的变化)探究草酸浓度对反应速率的影响,测得实验①③的溶液透光率-时间曲线如下所示。110-|||-90-|||-14 b-|||-70 7--|||-2-|||-3-|||-so ---|||-a-|||-30 +-|||-" 500 800 1000 1500 2000注:溶液透光率可表征溶液颜色的深浅。颜色越浅,透光率越大。(4)实验①~③所用草酸的浓度由大到小的顺序为 (填序号)。(5)a点和b点的速率大小关系:νa νb(填“>”、“<”或“=”)。(6)根据曲线,该小组推测Mn2+能作该反应的催化剂,并设计了如下实验:取与实验①浓度和体积均相同的反应物,再加入 ,测量该条件下溶液透光率的变化情况,说明Mn2+能作该反应催化剂的判断依据是 。
某小组以KMnO4和草酸(H2C2O4)的实验研究化学反应速率的影响因素,反应原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
Ⅰ.甲小组设计如下实验方案探究反应物浓度和溶液酸性对速率的影响:
【限选试剂和仪器】0.5mol⋅L−1H2C2O4溶液、0.05mol⋅L−1KMnO4溶液(末酸化)、5mol⋅L−1H2SO4溶液、试管、胶头滴管、秒表
Ⅰ.甲小组设计如下实验方案探究反应物浓度和溶液酸性对速率的影响:
【限选试剂和仪器】0.5mol⋅L−1H2C2O4溶液、0.05mol⋅L−1KMnO4溶液(末酸化)、5mol⋅L−1H2SO4溶液、试管、胶头滴管、秒表
| 序号 | V(H2C2O4)/mL | V(H2O)/mL | V(KMnO4)/mL | V(稀硫酸)/mL |
| Ⅰ | 2.0 | 1.0 | 1.0 | 1.0 |
| Ⅱ | 1.0 | 2.0 | a | 1.0 |
| Ⅲ | 2.0 | b | 1.0 | 2.0 |
(1)表中a= ,b= 。
(2)为定量比较反应速率的快慢,本实验应测量 。
(3)对比实验 和 (填序号)可探究溶液酸性对反应速率的影响。
Ⅱ.乙小组利用色度传感器(检测溶液颜色的变化)探究草酸浓度对反应速率的影响,测得实验①③的溶液透光率-时间曲线如下所示。
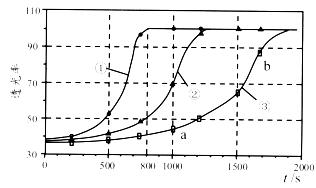
注:溶液透光率可表征溶液颜色的深浅。颜色越浅,透光率越大。
(4)实验①~③所用草酸的浓度由大到小的顺序为 (填序号)。
(5)a点和b点的速率大小关系:νa νb(填“>”、“<”或“=”)。
(6)根据曲线,该小组推测Mn2+能作该反应的催化剂,并设计了如下实验:取与实验①浓度和体积均相同的反应物,再加入 ,测量该条件下溶液透光率的变化情况,说明Mn2+能作该反应催化剂的判断依据是 。
(2)为定量比较反应速率的快慢,本实验应测量 。
(3)对比实验 和 (填序号)可探究溶液酸性对反应速率的影响。
Ⅱ.乙小组利用色度传感器(检测溶液颜色的变化)探究草酸浓度对反应速率的影响,测得实验①③的溶液透光率-时间曲线如下所示。

注:溶液透光率可表征溶液颜色的深浅。颜色越浅,透光率越大。
(4)实验①~③所用草酸的浓度由大到小的顺序为 (填序号)。
(5)a点和b点的速率大小关系:νa νb(填“>”、“<”或“=”)。
(6)根据曲线,该小组推测Mn2+能作该反应的催化剂,并设计了如下实验:取与实验①浓度和体积均相同的反应物,再加入 ,测量该条件下溶液透光率的变化情况,说明Mn2+能作该反应催化剂的判断依据是 。
题目解答
答案
(1) 1.0 0
(2)溶液褪色的时间
(3) Ⅰ Ⅲ
(4)①>②>③
(5)<
(6) 硫酸锰 在更短的时间内溶液透光率达到最大
(2)溶液褪色的时间
(3) Ⅰ Ⅲ
(4)①>②>③
(5)<
(6) 硫酸锰 在更短的时间内溶液透光率达到最大
解析
考查要点:本题主要考查化学反应速率影响因素的实验设计与数据分析,涉及控制变量法的应用、实验条件的控制、速率测量方法及催化剂的验证。
解题核心思路:
- 控制变量法:通过调整单一变量(如浓度、酸性等)设计对比实验,分析不同因素对反应速率的影响。
- 实验条件匹配:确保各实验组总体积一致,避免无关变量干扰。
- 速率定量比较:通过测量溶液褪色时间或透光率变化速率来比较反应快慢。
- 催化剂验证:通过添加催化剂观察反应速率的变化,结合实验现象得出结论。
破题关键点:
- 变量控制:明确每组实验中改变的变量(如酸性、浓度)和固定的变量。
- 数据关联:将透光率变化与反应物浓度、反应速率建立对应关系。
- 催化剂本质:催化剂通过降低活化能加快反应速率,需通过对比实验验证。
Ⅰ. 甲小组实验设计
(1) 表中a和b的值
关键思路:保持总体积一致,仅改变目标变量。
- 实验Ⅱ:与实验Ⅰ相比,H₂C₂O₄浓度降低(V=1.0mL),需保持总体积为4mL,则V(H₂O)=2.0mL,KMnO₄体积不变(a=1.0)。
- 实验Ⅲ:与实验Ⅰ相比,增加硫酸体积(V=2.0mL),需减少H₂O体积(b=0)以保持总体积为4mL。
(2) 反应速率的定量比较
关键方法:通过测量溶液褪色时间(高锰酸钾紫色消失)来比较反应速率快慢。
(3) 探究酸性影响的对比实验
变量控制:酸性由硫酸浓度决定。实验Ⅰ(稀硫酸1.0mL)与实验Ⅲ(稀硫酸2.0mL)对比,可探究酸性对速率的影响。
Ⅱ. 乙小组实验数据分析
(4) 草酸浓度排序
数据关联:透光率变化速率与草酸浓度正相关。实验①曲线斜率最大,说明初始浓度最高,故顺序为①>②>③。
(5) a点与b点速率比较
速率本质:反应速率随浓度降低而减小。a点(实验①后期)浓度低于b点(实验③初期),故νa < νb。
(6) 催化剂验证设计
验证方法:加入Mn²+(硫酸锰),若溶液透光率更快达到最大值,则说明Mn²+为催化剂。