题目
6-8 反应: _(2)(g)+(Br)_(2)(g)leftharpoons 2HBr(g) 在1297K和1495K时分别测-|||-得平衡常数为 ^theta (1297K)=1.6times (10)^5 ^theta (1495K)=3.5times (10)^4, 则此反应是-|||-() 。-|||-(A)放热反应 (B)吸热反应 (C)无热效应 (D)不能确定

题目解答
答案
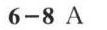
解析
考查要点:本题主要考查化学平衡常数与温度的关系,以及如何通过平衡常数的变化判断反应的热效应。
解题核心思路:
根据平衡常数随温度变化的趋势,结合范特霍夫方程或勒沙特列原理,判断反应的焓变(ΔH)。
- 吸热反应(ΔH > 0):升温会使平衡常数增大。
- 放热反应(ΔH < 0):升温会使平衡常数减小。
破题关键点:
题目中温度升高(1297K → 1495K),平衡常数下降($1.6 \times 10^5 \to 3.5 \times 10^4$),说明升温导致平衡逆向移动,正反应为放热反应。
步骤1:分析温度与平衡常数的关系
- 温度从1297K升高到1495K,平衡常数$K^\theta$从$1.6 \times 10^5$下降到$3.5 \times 10^4$。
- 平衡常数减小表明反应物的浓度增加或产物的浓度减少,即平衡逆向移动。
步骤2:结合勒沙特列原理
- 升温相当于向系统中“加入热量”。
- 若平衡逆向移动,则逆反应为吸热反应,正反应必为放热反应(ΔH < 0)。
步骤3:验证范特霍夫方程
范特霍夫方程为:
$\ln K = -\frac{\Delta H}{R} \cdot \frac{1}{T} + \text{常数}$
- 若ΔH < 0,升温(T增大)会导致$\ln K$减小,即$K$减小,与题目数据一致。