题目
全氮类物质具有高密度、高生成焓、超高能量及爆轰产物清洁无污染等优点,成为新一代超高能含能材料的典型代表。Ⅰ.高性能炸药BNCP的结构为NH3 N=N-|||-H3N Co-|||--N -NO2-|||-H3N -N-N= ClO4-|||-NH3 N=N-|||--NO2。(1)Co基态原子的核外电子排布式为 ____ ;O基态原子核外电子占据最高能级的电子云轮廓图形状为 ____ (用文字描述,下同); ClO4-的空间构型为 ____ 。(2)写出与NH3互为等电子体的阳离子的化学式 ____ ,NH3 N=N-|||-H3N Co-|||--N -NO2-|||-H3N -N-N= ClO4-|||-NH3 N=N-|||--NO2中所含各元素第一电离能由大到小的顺序为 ____ 。(用元素符号表示)Ⅱ.作为新型高能含能材料,AgN5在炸药、推进剂和发射药等领域具有较高的应用价值。(3)N5-为平面结构,结构为NH3 N=N-|||-H3N Co-|||--N -NO2-|||-H3N -N-N= ClO4-|||-NH3 N=N-|||--NO2,其中,原子的杂化方式是 ____ 。(4)AgN5的晶体结构与AgI相似。AgI的结构分为α-AgI和γ-AgI,γ-AgI立方晶胞的示意图如图1.图2是晶胞正上方的俯视投影图,图中黑球(实心球)表示Ⅰ-,请在图2中用白球(空心球)表示出Ag+的位置 ____ 。NH3 N=N-|||-H3N Co-|||--N -NO2-|||-H3N -N-N= ClO4-|||-NH3 N=N-|||--NO2(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图1中,原子1的坐标是((1)/(2),0,(1)/(2))则原子2的坐标为 ____ 。
全氮类物质具有高密度、高生成焓、超高能量及爆轰产物清洁无污染等优点,成为新一代超高能含能材料的典型代表。
Ⅰ.高性能炸药BNCP的结构为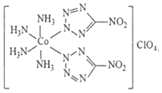 。
。
(1)Co基态原子的核外电子排布式为 ____ ;O基态原子核外电子占据最高能级的电子云轮廓图形状为 ____ (用文字描述,下同); ClO4-的空间构型为 ____ 。
(2)写出与NH3互为等电子体的阳离子的化学式 ____ ,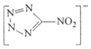 中所含各元素第一电离能由大到小的顺序为 ____ 。(用元素符号表示)
中所含各元素第一电离能由大到小的顺序为 ____ 。(用元素符号表示)
Ⅱ.作为新型高能含能材料,AgN5在炸药、推进剂和发射药等领域具有较高的应用价值。
(3)N5-为平面结构,结构为 ,其中,原子的杂化方式是 ____ 。
,其中,原子的杂化方式是 ____ 。
(4)AgN5的晶体结构与AgI相似。AgI的结构分为α-AgI和γ-AgI,γ-AgI立方晶胞的示意图如图1.图2是晶胞正上方的俯视投影图,图中黑球(实心球)表示Ⅰ-,请在图2中用白球(空心球)表示出Ag+的位置
____ 。
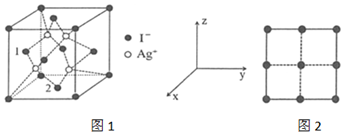
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图1中,原子1的坐标是($\frac{1}{2}$,0,$\frac{1}{2}$)则原子2的坐标为 ____ 。
Ⅰ.高性能炸药BNCP的结构为
 。
。(1)Co基态原子的核外电子排布式为 ____ ;O基态原子核外电子占据最高能级的电子云轮廓图形状为 ____ (用文字描述,下同); ClO4-的空间构型为 ____ 。
(2)写出与NH3互为等电子体的阳离子的化学式 ____ ,
 中所含各元素第一电离能由大到小的顺序为 ____ 。(用元素符号表示)
中所含各元素第一电离能由大到小的顺序为 ____ 。(用元素符号表示)Ⅱ.作为新型高能含能材料,AgN5在炸药、推进剂和发射药等领域具有较高的应用价值。
(3)N5-为平面结构,结构为
 ,其中,原子的杂化方式是 ____ 。
,其中,原子的杂化方式是 ____ 。(4)AgN5的晶体结构与AgI相似。AgI的结构分为α-AgI和γ-AgI,γ-AgI立方晶胞的示意图如图1.图2是晶胞正上方的俯视投影图,图中黑球(实心球)表示Ⅰ-,请在图2中用白球(空心球)表示出Ag+的位置
____ 。

(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图1中,原子1的坐标是($\frac{1}{2}$,0,$\frac{1}{2}$)则原子2的坐标为 ____ 。
题目解答
答案
解:(1)Co是27号元素,核外电子排布式为1s22s22p63s23p63d74s2;O元素处于第二周期第VIA族,电子占据最高能级为2p能级,最高能级的电子云轮廓图形状为纺锤形;ClO4-中Cl原子孤电子对数=$\frac{7+1-2×4}{2}$=0,价层电子对数=4+0=4,微粒空间构型为正四面体形,
故答案为:1s22s22p63s23p63d74s2;纺锤形;正四面体形;
(2)用O原子与1个单位正电荷替换N原子可得与NH3互为等电子体的阳离子:H3O+;同周期随原子序数增大第一电离能呈增大趋势,N元素原子2P轨道为半充满稳定状态,第一电离能高于O元素的,故第一电离能N>O>C,
故答案为:H3O+;N>O>C;
(3)N5-为平面结构,结构为 ,N原子均有1对孤对电子,N原子为sp2杂化,
,N原子均有1对孤对电子,N原子为sp2杂化,
故答案为:sp2;
(4)晶胞中4个白色球投影处于图2中4个小正方形的中心位置,在图2中用白球(空心球)表示出Ag+的位置为: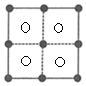 ,
,
故答案为: ;
;
(5)原子2位于下底面面心,x、y参数均为$\frac{1}{2}$,z参数为0,原子2的坐标为 ($\frac{1}{2}$,$\frac{1}{2}$,0),
故答案为:($\frac{1}{2}$,$\frac{1}{2}$,0)。
故答案为:1s22s22p63s23p63d74s2;纺锤形;正四面体形;
(2)用O原子与1个单位正电荷替换N原子可得与NH3互为等电子体的阳离子:H3O+;同周期随原子序数增大第一电离能呈增大趋势,N元素原子2P轨道为半充满稳定状态,第一电离能高于O元素的,故第一电离能N>O>C,
故答案为:H3O+;N>O>C;
(3)N5-为平面结构,结构为
 ,N原子均有1对孤对电子,N原子为sp2杂化,
,N原子均有1对孤对电子,N原子为sp2杂化,故答案为:sp2;
(4)晶胞中4个白色球投影处于图2中4个小正方形的中心位置,在图2中用白球(空心球)表示出Ag+的位置为:
 ,
,故答案为:
 ;
;(5)原子2位于下底面面心,x、y参数均为$\frac{1}{2}$,z参数为0,原子2的坐标为 ($\frac{1}{2}$,$\frac{1}{2}$,0),
故答案为:($\frac{1}{2}$,$\frac{1}{2}$,0)。
解析
考查要点:本题综合考查原子结构、分子结构、等电子体、电离能、杂化轨道、晶胞结构等知识点。
解题思路:
- 电子排布与电子云:根据原子序号确定电子排布式,结合能级判断电子云形状。
- 空间构型与杂化:利用VSEPR理论分析分子构型,结合孤电子对数和价层电子对数;根据几何结构判断杂化方式。
- 等电子体与电离能:等电子体需满足原子数和价电子数相等;同周期内第一电离能呈增大趋势,但需注意半充满稳定性的异常情况。
- 晶胞结构与坐标:根据晶胞投影图确定离子位置,利用分数坐标系表示原子位置。
Ⅰ.高性能炸药BNCP的结构分析
(1)Co基态原子的电子排布式、O的电子云形状、ClO₄⁻的空间构型
关键步骤:
- Co的电子排布:Co原子序数为27,基态电子排布遵循构造量子数顺序,注意3d和4s轨道的填充。
- O的最高能级:O的最高能级为2p,电子云轮廓为纺锤形。
- ClO₄⁻的构型:Cl为中心原子,孤电子对数为0,价层电子对数为4,故为正四面体型。
(2)等电子体阳离子、第一电离能顺序
关键步骤:
- 等电子体:NH₃的等电子体需原子数为4、价电子数为10,阳离子为H₃O⁺。
- 电离能比较:同周期中N的2p轨道半充满,电离能高于O和C。
Ⅱ.AgN₅的结构与晶胞分析
(3)N₅⁻的杂化方式
关键步骤:
- 平面结构分析:每个N原子有1对孤对电子,价层电子对数为3,故为sp²杂化。
(4)Ag⁺在晶胞中的位置
关键步骤:
- 晶胞投影:γ-AgI中Ag⁺位于面心,俯视图中白球应位于四个小正方形中心。
(5)原子2的分数坐标
关键步骤:
- 坐标系规则:原子2位于下底面面心,坐标为$(\frac{1}{2}, \frac{1}{2}, 0)$。