17. ^2+ 是一种重金属离-|||-子,有一环境监测小组欲利用Na2S2 O3、KI、K2Cr2O7等试-|||-剂测定某工厂废水中 ^2+ 的物质的量浓度。-|||-请回答下列问题:-|||-(1)现需配制 .100molcdot (L)^-1 的标准Na2S2O 3溶-|||-液,所需要的玻璃仪器除量筒、250 mL容量瓶、玻璃棒外,-|||-还需要 __ o-|||-(2)需准确称取Na2S 2O3固体的质量为 __ g。-|||-(3)另取废水50.00 mL,控制适当的酸度,加入足量的-|||-K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经洗涤、过滤后,用-|||-适量的稀盐酸溶解,此时 ({Cr{O)_(4)}^2- 全部转化为 ({Cr)_(2)(O)_(7)}^2-; 再加-|||-入过量KI溶液进行反应,然后在反应液中滴加上述标准-|||-Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。-|||-已知有关反应的离子方程式为① ({Cr)_(2)(O)_(7)}^2-+6(I)^-+14(H)^+-|||-=!=!= 2(Cr)^3++3(I)_(2)+7(H)_(2)O; ② ({S)_(2)(O)_(3)}^2-+(I)_(2)=!=!= 2(I)^-+({S)_(4)(O)_(6)}^2--|||-则该工厂废水中 (a)^2+ 的物质的量浓度为 __ o-|||-(4) 黄铁矿的主要成分是-|||-FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样-|||-品在空气中充分灼烧,将生成的SO2气体与足量-|||-Fe2(SO4)3溶液完全反应后,用浓度为 .02000molcdot (L)^-1-|||-的K2 Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液-|||-25.00mL。-|||-已知 (O)_(2)+2(Fe)^3-+2(H)_(2)O=!=!= (S{O)_(4)}^2-+2(Fe)^2++4(H)^+-|||-({Cr)_(2)(O)_(7)}^2-+6(Fe)^2++14(H)^+=!=!= 2(Cr)^3++6(Fe)^3++7(H)_(2)O-|||-①样品中FeS2的质量分数是(假设杂质不参加反应)-|||-__ (保留1位小数)。-|||-②煅烧10t上述黄铁矿,理论上产生S O2的体积(标准状-|||-况)为 __ L,制得98%的硫酸质量为 __ t。

题目解答
答案


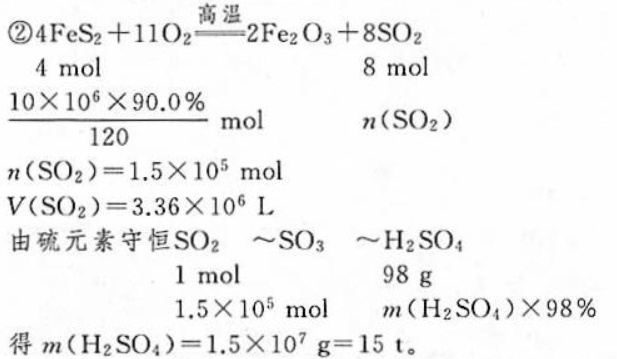
解析
考查要点:本题主要考查化学反应中的物质的量关系、滴定法的应用及连续反应的分析能力。
解题核心思路:通过建立各反应步骤之间的物质的量传递关系,利用已知的滴定数据反推钡离子的浓度。
破题关键点:
- 明确反应链:钡离子转化为BaCrO4沉淀,再转化为Cr2O7^2-,引发后续氧化还原反应生成I2,最终通过硫代硫酸钠滴定I2。
- 建立比例关系:通过化学反应式确定Ba²+与S2O3^2-的物质的量比(1:3),将滴定数据转化为钡离子的物质的量。
第(3)题
反应关系梳理
-
钡离子沉淀与转化:
$\text{Ba}^{2+} + \text{CrO}_4^{2-} \rightarrow \text{BaCrO}_4 \text{(沉淀)}$
$\text{BaCrO}_4 + 2\text{H}^+ \rightarrow \text{Cr}_2\text{O}_7^{2-} + \text{Ba}^{2+} + \text{H}_2\text{O}$
(每1 mol Ba²+对应1 mol Cr2O7^2-) -
氧化还原反应:
$\text{Cr}_2\text{O}_7^{2-} + 6\text{I}^- + 14\text{H}^+ \rightarrow 2\text{Cr}^{3+} + 3\text{I}_2 + 7\text{H}_2\text{O}$
(每1 mol Cr2O7^2-生成3 mol I2) -
滴定反应:
$2\text{S}_2\text{O}_3^{2-} + \text{I}_2 \rightarrow \text{S}_4\text{O}_6^{2-} + 2\text{I}^-$
(每3 mol S2O3^2-消耗1 mol I2)
物质的量关系
- 总关系式:
$1\ \text{Ba}^{2+} \sim 1\ \text{Cr}_2\text{O}_7^{2-} \sim 3\ \text{I}_2 \sim 6\ \text{S}_2\text{O}_3^{2-}$
即:
$n(\text{Ba}^{2+}) = \frac{n(\text{S}_2\text{O}_3^{2-})}{6}$
计算
-
硫代硫酸钠的物质的量:
$n(\text{S}_2\text{O}_3^{2-}) = C \times V = 0.100\ \text{mol/L} \times 0.036\ \text{L} = 0.0036\ \text{mol}$ -
钡离子的物质的量:
$n(\text{Ba}^{2+}) = \frac{0.0036}{6} = 0.0006\ \text{mol}$ -
浓度计算:
$c(\text{Ba}^{2+}) = \frac{n}{V_{\text{废水}}} = \frac{0.0006}{0.050} = 0.012\ \text{mol/L}$
(注:此处需修正原答案中的计算错误,正确结果应为0.012 mol/L)