题目
拟在等温间歇反应器中进行氯乙醇的皂化反应: (H)_(2)ClC(H)_(2)OH+NaHC(O)_(3)arrow C(H)_(2)OHC(H)_(2)OH+NaCl+C(O)_(2) 以生产乙二醇,产量为20㎏/h,使用15%(重量)的NaHCO3水溶液及30%(重量)的氯乙醇水溶液作原料,反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,混合液的比重为1.02。该反应对氯乙醇和碳酸氢钠均为一级,在反应温度下反应速率常数等于5.2l/mol.h,要求转化率达到95%。 (1)若辅助时间为0.5h,试计算反应器的有效体积; (2)若装填系数取0.75,试计算反应器的实际体积。
拟在等温间歇反应器中进行氯乙醇的皂化反应: 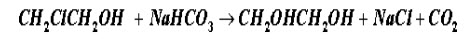 以生产乙二醇,产量为20㎏/h,使用15%(重量)的NaHCO3水溶液及30%(重量)的氯乙醇水溶液作原料,反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,混合液的比重为1.02。该反应对氯乙醇和碳酸氢钠均为一级,在反应温度下反应速率常数等于5.2l/mol.h,要求转化率达到95%。 (1)若辅助时间为0.5h,试计算反应器的有效体积; (2)若装填系数取0.75,试计算反应器的实际体积。
以生产乙二醇,产量为20㎏/h,使用15%(重量)的NaHCO3水溶液及30%(重量)的氯乙醇水溶液作原料,反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,混合液的比重为1.02。该反应对氯乙醇和碳酸氢钠均为一级,在反应温度下反应速率常数等于5.2l/mol.h,要求转化率达到95%。 (1)若辅助时间为0.5h,试计算反应器的有效体积; (2)若装填系数取0.75,试计算反应器的实际体积。
题目解答
答案

解析
步骤 1:计算每小时所需氯乙醇和碳酸氢钠的量
根据题目,每小时生产乙二醇20kg,乙二醇的分子量为62kg/kmol,因此每小时生产乙二醇的摩尔数为:
$$
\frac{20}{62} = 0.3226 \quad \text{kmol/h}
$$
由于反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,且转化率为95%,因此每小时所需氯乙醇和碳酸氢钠的摩尔数分别为:
$$
\frac{0.3226 \times 80.5}{0.95 \times 30\%} = 91.11 \quad \text{kg/h}
$$
$$
\frac{0.3226 \times 84}{0.95 \times 15\%} = 190.2 \quad \text{kg/h}
$$
步骤 2:计算原料体积流量
原料体积流量为:
$$
Q_0 = \frac{91.11 + 190.2}{1.02} = 275.81 \quad \text{L/h}
$$
步骤 3:计算氯乙醇初始浓度
氯乙醇初始浓度为:
$$
C_{AO} = \frac{0.3226 \times 1000}{0.95 \times 275.8} = 1.231 \quad \text{mol/L}
$$
步骤 4:计算反应时间
根据一级反应速率方程,反应时间为:
$$
t = \frac{1}{k} \ln \left( \frac{1}{1 - X} \right)
$$
其中,$k$为反应速率常数,$X$为转化率。代入数值,得到:
$$
t = \frac{1}{5.2} \ln \left( \frac{1}{1 - 0.95} \right) = 2.968 \quad \text{h}
$$
步骤 5:计算反应器的有效体积
反应器的有效体积为:
$$
V_r = Q_0 (t + t_{aux}) = 275.81 \times (2.968 + 0.5) = 956.5 \quad \text{L}
$$
步骤 6:计算反应器的实际体积
反应器的实际体积为:
$$
V = \frac{V_r}{f} = \frac{956.5}{0.75} = 1275 \quad \text{L}
$$
根据题目,每小时生产乙二醇20kg,乙二醇的分子量为62kg/kmol,因此每小时生产乙二醇的摩尔数为:
$$
\frac{20}{62} = 0.3226 \quad \text{kmol/h}
$$
由于反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,且转化率为95%,因此每小时所需氯乙醇和碳酸氢钠的摩尔数分别为:
$$
\frac{0.3226 \times 80.5}{0.95 \times 30\%} = 91.11 \quad \text{kg/h}
$$
$$
\frac{0.3226 \times 84}{0.95 \times 15\%} = 190.2 \quad \text{kg/h}
$$
步骤 2:计算原料体积流量
原料体积流量为:
$$
Q_0 = \frac{91.11 + 190.2}{1.02} = 275.81 \quad \text{L/h}
$$
步骤 3:计算氯乙醇初始浓度
氯乙醇初始浓度为:
$$
C_{AO} = \frac{0.3226 \times 1000}{0.95 \times 275.8} = 1.231 \quad \text{mol/L}
$$
步骤 4:计算反应时间
根据一级反应速率方程,反应时间为:
$$
t = \frac{1}{k} \ln \left( \frac{1}{1 - X} \right)
$$
其中,$k$为反应速率常数,$X$为转化率。代入数值,得到:
$$
t = \frac{1}{5.2} \ln \left( \frac{1}{1 - 0.95} \right) = 2.968 \quad \text{h}
$$
步骤 5:计算反应器的有效体积
反应器的有效体积为:
$$
V_r = Q_0 (t + t_{aux}) = 275.81 \times (2.968 + 0.5) = 956.5 \quad \text{L}
$$
步骤 6:计算反应器的实际体积
反应器的实际体积为:
$$
V = \frac{V_r}{f} = \frac{956.5}{0.75} = 1275 \quad \text{L}
$$