题目
“碳中和”引起各国的高度重视,正成为科学家研究的主要课题。利用CO2合成二甲醚有两种工艺。工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:Ⅰ.甲醇的合成:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)Ⅱ.逆水汽变换:CO2(g)+H2(g)⇌CO(g)+H2O(g)再通过设备二由甲醇脱水合成二甲醚。Ⅲ.甲醇脱水:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。已知:相关物质变化的焓变示意图如图。Delta H=+82.4kJcdot (mol)^-1-|||-(O)_(2)(g)+6(H)_(2)(g)-|||-Delta H=-99.2kJcdot (mol)^-1-|||-(H)_(3)OH(g)+2(H)_(2)O(g)-|||-个 Delta H=+23.9KJcdot (mol)^-1 CH3OCH3(g)+3H2O(g)(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式: ____ 。(2)工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。Delta H=+82.4kJcdot (mol)^-1-|||-(O)_(2)(g)+6(H)_(2)(g)-|||-Delta H=-99.2kJcdot (mol)^-1-|||-(H)_(3)OH(g)+2(H)_(2)O(g)-|||-个 Delta H=+23.9KJcdot (mol)^-1 CH3OCH3(g)+3H2O(g)下列说法正确的是 ____ 。A.图甲纵坐标表示CH3OH的平衡产率B.p1>p2>p3C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向(3)解释图乙中压强一定时,曲线随温度变化先降后升的原因 ____ 。(4)假定工艺2在一定温度下,控制恒容0.6L的刚性容器中进行,不考虑反应Ⅱ的逆水汽变换及其他副反应,将1mol CO2与3mol H2与双功能催化剂充分接触反应,测定CO2的平衡转化率为80%,CH3OCH3选择性为50%,求此温度下反应Ⅳ的平衡常数K= ____ 。(CH3OCH3选择性=(2×C(H)_(3)OC(H)_(3)的物质的量)/(参加反应的C(O)_{2)物质的量}×100%)(5)工艺2使用的双功能催化剂通常由甲醇合成活性中心和甲醇脱水活性中心组成,前者常采用铜基催化剂,后者主要是γ-Al2O3。在一定条件下,将CO2与H2以1:3投料比通过双功能催化剂,测定含碳产物的物质的量分数随时间变化如图所示。研究发现,采用Li-Pd/SiO2代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图上画出采用Li-Pd/SiO2与γ-Al2O3复合催化剂作用下,CH3OH物质的量分数随时间变化的曲线 ____ 。Delta H=+82.4kJcdot (mol)^-1-|||-(O)_(2)(g)+6(H)_(2)(g)-|||-Delta H=-99.2kJcdot (mol)^-1-|||-(H)_(3)OH(g)+2(H)_(2)O(g)-|||-个 Delta H=+23.9KJcdot (mol)^-1 CH3OCH3(g)+3H2O(g)
“碳中和”引起各国的高度重视,正成为科学家研究的主要课题。利用CO2合成二甲醚有两种工艺。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
Ⅱ.逆水汽变换:CO2(g)+H2(g)⇌CO(g)+H2O(g)
再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)
工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
已知:相关物质变化的焓变示意图如图。
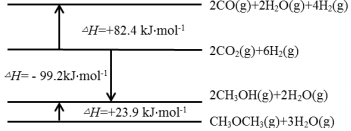
(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式: ____ 。
(2)工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。
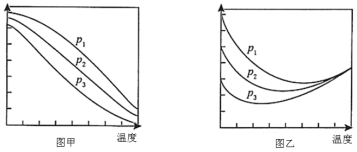
下列说法正确的是 ____ 。
A.图甲纵坐标表示CH3OH的平衡产率
B.p1>p2>p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
(3)解释图乙中压强一定时,曲线随温度变化先降后升的原因 ____ 。
(4)假定工艺2在一定温度下,控制恒容0.6L的刚性容器中进行,不考虑反应Ⅱ的逆水汽变换及其他副反应,将1mol CO2与3mol H2与双功能催化剂充分接触反应,测定CO2的平衡转化率为80%,CH3OCH3选择性为50%,求此温度下反应Ⅳ的平衡常数K= ____ 。(CH3OCH3选择性=$\frac{2×C{H}_{3}OC{H}_{3}的物质的量}{参加反应的C{O}_{2}物质的量}$×100%)
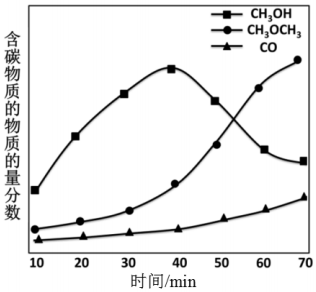
(5)工艺2使用的双功能催化剂通常由甲醇合成活性中心和甲醇脱水活性中心组成,前者常采用铜基催化剂,后者主要是γ-Al2O3。在一定条件下,将CO2与H2以1:3投料比通过双功能催化剂,测定含碳产物的物质的量分数随时间变化如图所示。研究发现,采用Li-Pd/SiO2代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图上画出采用Li-Pd/SiO2与γ-Al2O3复合催化剂作用下,CH3OH物质的量分数随时间变化的曲线 ____ 。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
Ⅱ.逆水汽变换:CO2(g)+H2(g)⇌CO(g)+H2O(g)
再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)
工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
已知:相关物质变化的焓变示意图如图。

(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式: ____ 。
(2)工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。

下列说法正确的是 ____ 。
A.图甲纵坐标表示CH3OH的平衡产率
B.p1>p2>p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
(3)解释图乙中压强一定时,曲线随温度变化先降后升的原因 ____ 。
(4)假定工艺2在一定温度下,控制恒容0.6L的刚性容器中进行,不考虑反应Ⅱ的逆水汽变换及其他副反应,将1mol CO2与3mol H2与双功能催化剂充分接触反应,测定CO2的平衡转化率为80%,CH3OCH3选择性为50%,求此温度下反应Ⅳ的平衡常数K= ____ 。(CH3OCH3选择性=$\frac{2×C{H}_{3}OC{H}_{3}的物质的量}{参加反应的C{O}_{2}物质的量}$×100%)
(5)工艺2使用的双功能催化剂通常由甲醇合成活性中心和甲醇脱水活性中心组成,前者常采用铜基催化剂,后者主要是γ-Al2O3。在一定条件下,将CO2与H2以1:3投料比通过双功能催化剂,测定含碳产物的物质的量分数随时间变化如图所示。研究发现,采用Li-Pd/SiO2代替铜基催化剂在甲醇合成阶段有更佳的催化效果。在图上画出采用Li-Pd/SiO2与γ-Al2O3复合催化剂作用下,CH3OH物质的量分数随时间变化的曲线 ____ 。

题目解答
答案
解:(1)根据相关物质变化的焓变示意图可得:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H=-(99.2+23.9)kJ/mol=-123.1kJ/mol,
故答案为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H=-123.1kJ/mol;
(2)A.由于合成甲醇的正反应是放热反应,因此低温阶段,随温度升高,平衡逆向移动,CO2的平衡转化率降低,CH3OH的平衡产率降低,而逆水汽变换反应的正反应为吸热反应,温度升高到一定程度时主要发生逆水汽变换反应,则温度升高,CO2的平衡转化率升高,即图甲纵坐标表示CH3OH的平衡产率,图乙纵坐标表示CO2的平衡转化率,故A正确;
B.合成甲醇的反应为气体分子总数减小的反应,逆水汽变换反应为气体分子总数不变的反应,因此压强增大,CO2的平衡转化率升高,因此,压强的大小顺序为:p1>p2>p3,故B正确;
C.根据上述分析可知,为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件,故C正确;
D.催化剂对平衡移动无影响,使用催化剂不能提高CO2的平衡转化率,故D错误;
故答案为:ABC;
(3)由于合成甲醇的正反应是放热反应,因此低温阶段,升高温度时,以反应Ⅰ为主,反应放热,温度升高,平衡逆向移动,CO2的平衡转化率下降,升高到一定温度后,以反应Ⅱ为主,即主要发生逆水汽变换反应,反应吸热,平衡正向移动,CO2的平衡转化率上升,
故答案为:低温阶段升高温度时,以反应Ⅰ为主,反应放热,温度升高,平衡逆向移动,CO2的平衡转化率下降,升高到一定温度后,以反应Ⅱ为主,即主要发生逆水汽变换反应,反应吸热,平衡正向移动,CO2的平衡转化率上升;
(4)初始时CO2为1mol、H2为3mol,CO2的平衡转化率为80%,即参加反应的n(CO2)=0.8mol,参加反应的n(H2)=2.4mol,生成的CH3OH为0.8mol,根据关系式CH3OH~CH3OCH3以及生成CH3OCH3选择性为50%,可知生成的CH3OCH3物质的量为0.2mol,同时生成的水为0.6mol,参与反应的CH3OH为0.4mol,水为0.4mol,则平衡时n(CO2)=0.2mol,n(H2)=0.6mol,n(CH3OH)=0.4mol,n(CH3OCH3)=0.2mol,n(H2O)=(0.6+0.4)mol=1mol,平衡浓度为c(CO2)=$\frac{0.2}{0.6}$mol/L,c(H2)=$\frac{0.6}{0.6}$mol/L,c(CH3OH)=$\frac{0.4}{0.6}$mol/L,c(CH3OCH3)=$\frac{0.2}{0.6}$mol/L,c(H2O)=$\frac{1}{0.6}$mol/L,故平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$=$\frac{\frac{1}{3}×(\frac{1}{0.6})^{3}}{(\frac{1}{3})^{2}×{1}^{6}}$=$\frac{125}{9}$,
故答案为:$\frac{125}{9}$;
(5)催化剂可以加快反应速率,缩短反应时间,因此甲醇的物质的量分数会在较短时间内达到最大值,且高于未使用催化剂时甲醇的物质的量分数,但最终平衡时甲醇的物质的量分数不变,结果如图所示: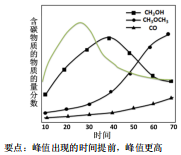 ,
,
故答案为: 。
。
故答案为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H=-123.1kJ/mol;
(2)A.由于合成甲醇的正反应是放热反应,因此低温阶段,随温度升高,平衡逆向移动,CO2的平衡转化率降低,CH3OH的平衡产率降低,而逆水汽变换反应的正反应为吸热反应,温度升高到一定程度时主要发生逆水汽变换反应,则温度升高,CO2的平衡转化率升高,即图甲纵坐标表示CH3OH的平衡产率,图乙纵坐标表示CO2的平衡转化率,故A正确;
B.合成甲醇的反应为气体分子总数减小的反应,逆水汽变换反应为气体分子总数不变的反应,因此压强增大,CO2的平衡转化率升高,因此,压强的大小顺序为:p1>p2>p3,故B正确;
C.根据上述分析可知,为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件,故C正确;
D.催化剂对平衡移动无影响,使用催化剂不能提高CO2的平衡转化率,故D错误;
故答案为:ABC;
(3)由于合成甲醇的正反应是放热反应,因此低温阶段,升高温度时,以反应Ⅰ为主,反应放热,温度升高,平衡逆向移动,CO2的平衡转化率下降,升高到一定温度后,以反应Ⅱ为主,即主要发生逆水汽变换反应,反应吸热,平衡正向移动,CO2的平衡转化率上升,
故答案为:低温阶段升高温度时,以反应Ⅰ为主,反应放热,温度升高,平衡逆向移动,CO2的平衡转化率下降,升高到一定温度后,以反应Ⅱ为主,即主要发生逆水汽变换反应,反应吸热,平衡正向移动,CO2的平衡转化率上升;
(4)初始时CO2为1mol、H2为3mol,CO2的平衡转化率为80%,即参加反应的n(CO2)=0.8mol,参加反应的n(H2)=2.4mol,生成的CH3OH为0.8mol,根据关系式CH3OH~CH3OCH3以及生成CH3OCH3选择性为50%,可知生成的CH3OCH3物质的量为0.2mol,同时生成的水为0.6mol,参与反应的CH3OH为0.4mol,水为0.4mol,则平衡时n(CO2)=0.2mol,n(H2)=0.6mol,n(CH3OH)=0.4mol,n(CH3OCH3)=0.2mol,n(H2O)=(0.6+0.4)mol=1mol,平衡浓度为c(CO2)=$\frac{0.2}{0.6}$mol/L,c(H2)=$\frac{0.6}{0.6}$mol/L,c(CH3OH)=$\frac{0.4}{0.6}$mol/L,c(CH3OCH3)=$\frac{0.2}{0.6}$mol/L,c(H2O)=$\frac{1}{0.6}$mol/L,故平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$=$\frac{\frac{1}{3}×(\frac{1}{0.6})^{3}}{(\frac{1}{3})^{2}×{1}^{6}}$=$\frac{125}{9}$,
故答案为:$\frac{125}{9}$;
(5)催化剂可以加快反应速率,缩短反应时间,因此甲醇的物质的量分数会在较短时间内达到最大值,且高于未使用催化剂时甲醇的物质的量分数,但最终平衡时甲醇的物质的量分数不变,结果如图所示:
 ,
,故答案为:
 。
。