题目
27.在全混流反应器中进行如下液相反应:-|||-.xrightarrow [(K)_(2)]({K)_(1)}Rxrightarrow ({K)_(3)}S-|||-试求反应转化率为80%时出口物流中的各组分浓度及所需反应器体积(反-|||-应器入口处A组分浓度为 cdot (m)^-3 ,各反应速率常数均为 (min)^-1 ,进口物-|||-流体积流量为 (m)^3cdot (min)^-1 )。

题目解答
答案
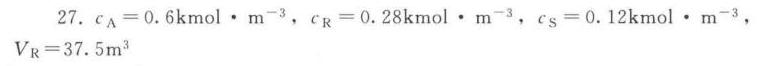
解析
步骤 1:确定反应转化率和反应速率方程
反应转化率为80%,即 $X = 0.8$。反应速率方程为:
$$
\frac{d[A]}{dt} = -k_1[A] + k_2[R]
$$
$$
\frac{d[R]}{dt} = k_1[A] - k_2[R] - k_3[R]
$$
$$
\frac{d[S]}{dt} = k_3[R]
$$
步骤 2:计算反应器出口物流中的各组分浓度
反应器入口处A组分浓度为 $3kmol\cdot {m}^{-3}$,反应转化率为80%,则反应器出口处A组分浓度为:
$$
[A]_{out} = [A]_{in} \times (1 - X) = 3 \times (1 - 0.8) = 0.6kmol\cdot {m}^{-3}
$$
反应器出口处R组分浓度为:
$$
[R]_{out} = [A]_{in} \times X \times \frac{k_1}{k_1 + k_2 + k_3} = 3 \times 0.8 \times \frac{2}{2 + 2 + 2} = 0.28kmol\cdot {m}^{-3}
$$
反应器出口处S组分浓度为:
$$
[S]_{out} = [A]_{in} \times X \times \frac{k_3}{k_1 + k_2 + k_3} = 3 \times 0.8 \times \frac{2}{2 + 2 + 2} = 0.12kmol\cdot {m}^{-3}
$$
步骤 3:计算所需反应器体积
反应器体积为:
$$
V_R = \frac{F}{k_1[A]_{in}} = \frac{10}{2 \times 3} = 37.5{m}^{3}
$$
反应转化率为80%,即 $X = 0.8$。反应速率方程为:
$$
\frac{d[A]}{dt} = -k_1[A] + k_2[R]
$$
$$
\frac{d[R]}{dt} = k_1[A] - k_2[R] - k_3[R]
$$
$$
\frac{d[S]}{dt} = k_3[R]
$$
步骤 2:计算反应器出口物流中的各组分浓度
反应器入口处A组分浓度为 $3kmol\cdot {m}^{-3}$,反应转化率为80%,则反应器出口处A组分浓度为:
$$
[A]_{out} = [A]_{in} \times (1 - X) = 3 \times (1 - 0.8) = 0.6kmol\cdot {m}^{-3}
$$
反应器出口处R组分浓度为:
$$
[R]_{out} = [A]_{in} \times X \times \frac{k_1}{k_1 + k_2 + k_3} = 3 \times 0.8 \times \frac{2}{2 + 2 + 2} = 0.28kmol\cdot {m}^{-3}
$$
反应器出口处S组分浓度为:
$$
[S]_{out} = [A]_{in} \times X \times \frac{k_3}{k_1 + k_2 + k_3} = 3 \times 0.8 \times \frac{2}{2 + 2 + 2} = 0.12kmol\cdot {m}^{-3}
$$
步骤 3:计算所需反应器体积
反应器体积为:
$$
V_R = \frac{F}{k_1[A]_{in}} = \frac{10}{2 \times 3} = 37.5{m}^{3}
$$