题目
将锡和铅的金属片分别插入含有该金属离子的溶液中并组成原电池(用图示表示,要注明浓度)。(1)(({S)_(n)}^2+)=0.0100molcdot (dm)^-3;(({S)_(n)}^2+)=0.0100molcdot (dm)^-3(2)(({S)_(n)}^2+)=0.0100molcdot (dm)^-3;(({S)_(n)}^2+)=0.0100molcdot (dm)^-3分别计算原电池的电动势,写出原电池的两电极反应和电池总反应式。
将锡和铅的金属片分别插入含有该金属离子的溶液中并组成原电池(用图示表示,要注明浓度)。
(1)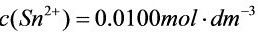 ;
;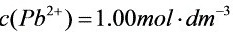
(2)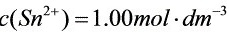 ;
;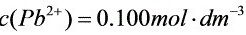
分别计算原电池的电动势,写出原电池的两电极反应和电池总反应式。
题目解答
答案
解:查教材附录,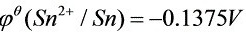 ,
,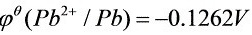
(1)当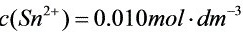 ;
;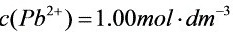 时:
时:
故以锡电极做原电池负极,铅电极做正极。
原电池图示为: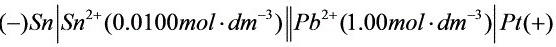
正极反应: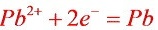
负极反应: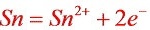
电池总反应式: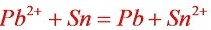
原电池电动势: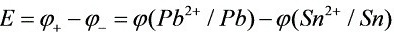
=-0.1262V-(-0.197)V=0.071V
(2)当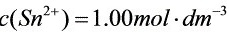 ;
;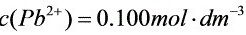 时:
时:
故以铅电极做原电池负极,锡电极做正极。
原电池图示为: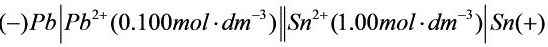
正极反应: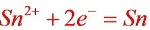
负极反应: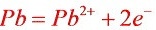
电池总反应式: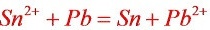
原电池电动势: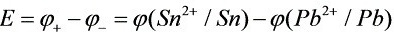
=-0.1375V-(-0.156)V=0.019V
解析
步骤 1:确定电极电势
查教材附录,得到标准电极电势:${\varphi }^{\theta }({\sin }^{2+}/{S}_{n})=-0.1375V$,${\varphi }^{\theta }({P{b}^{2+}}^{2+}/Pb)=-0.1262V$。
步骤 2:计算电极电势
根据能斯特方程,计算电极电势。对于锡电极,${\varphi }({Sn}^{2+}/Sn)={\varphi }^{\theta }({Sn}^{2+}/Sn)+\frac{RT}{2F}ln\frac{1}{c({Sn}^{2+})}$。对于铅电极,${\varphi }({Pb}^{2+}/Pb)={\varphi }^{\theta }({Pb}^{2+}/Pb)+\frac{RT}{2F}ln\frac{1}{c({Pb}^{2+})}$。
步骤 3:确定正负极
比较计算出的电极电势,电势较低的电极作为负极,电势较高的电极作为正极。
步骤 4:计算电动势
原电池电动势$E=\varphi_{正}-\varphi_{负}$。
步骤 5:写出电极反应和电池总反应式
根据正负极确定电极反应,然后写出电池总反应式。
查教材附录,得到标准电极电势:${\varphi }^{\theta }({\sin }^{2+}/{S}_{n})=-0.1375V$,${\varphi }^{\theta }({P{b}^{2+}}^{2+}/Pb)=-0.1262V$。
步骤 2:计算电极电势
根据能斯特方程,计算电极电势。对于锡电极,${\varphi }({Sn}^{2+}/Sn)={\varphi }^{\theta }({Sn}^{2+}/Sn)+\frac{RT}{2F}ln\frac{1}{c({Sn}^{2+})}$。对于铅电极,${\varphi }({Pb}^{2+}/Pb)={\varphi }^{\theta }({Pb}^{2+}/Pb)+\frac{RT}{2F}ln\frac{1}{c({Pb}^{2+})}$。
步骤 3:确定正负极
比较计算出的电极电势,电势较低的电极作为负极,电势较高的电极作为正极。
步骤 4:计算电动势
原电池电动势$E=\varphi_{正}-\varphi_{负}$。
步骤 5:写出电极反应和电池总反应式
根据正负极确定电极反应,然后写出电池总反应式。