题目
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图1所示。k-|||-六方相氮化硼-|||-9-|||-°原原子-|||-硼原子-|||-o o-|||-o-|||-立方相氮化硼-|||-乙-|||-图2(1)基态硼原子的电子排布式为 ____ 。(2)下列关于这两种晶体的说法,正确的是 ____ (填序号)a.立方相氮化硼含有σ键和π键,所以硬度大b.六方相氮化硼层间作用力小,所以质地软c.两种晶体的B-N键均为共价键d.两种晶体均为分子晶体e.立方相氮化硼的晶体晶胞中,含有4个B原子,4个N原子(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为 ____ ,其结构与石墨相似却不导电,原因是 ____ 。(4)立方氮化硼和金刚石是等电子体,其晶胞如图2所示,则处于晶胞顶点上的原子配位数为 ____ ,若晶胞边长为361.5pm,则立方氮化硼的密度是 ____ g•cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,1mol NH4BF4含有 ____ mol配位键。
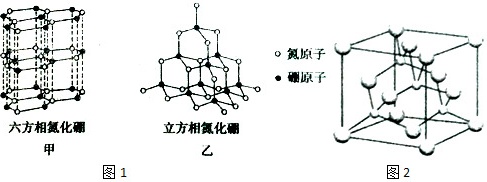
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图1所示。
(1)基态硼原子的电子排布式为 ____ 。
(2)下列关于这两种晶体的说法,正确的是 ____ (填序号)
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体的B-N键均为共价键
d.两种晶体均为分子晶体
e.立方相氮化硼的晶体晶胞中,含有4个B原子,4个N原子
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为 ____ ,其结构与石墨相似却不导电,原因是 ____ 。
(4)立方氮化硼和金刚石是等电子体,其晶胞如图2所示,则处于晶胞顶点上的原子配位数为 ____ ,若晶胞边长为361.5pm,则立方氮化硼的密度是 ____ g•cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,1mol NH4BF4含有 ____ mol配位键。

(1)基态硼原子的电子排布式为 ____ 。
(2)下列关于这两种晶体的说法,正确的是 ____ (填序号)
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体的B-N键均为共价键
d.两种晶体均为分子晶体
e.立方相氮化硼的晶体晶胞中,含有4个B原子,4个N原子
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为 ____ ,其结构与石墨相似却不导电,原因是 ____ 。
(4)立方氮化硼和金刚石是等电子体,其晶胞如图2所示,则处于晶胞顶点上的原子配位数为 ____ ,若晶胞边长为361.5pm,则立方氮化硼的密度是 ____ g•cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,1mol NH4BF4含有 ____ mol配位键。
题目解答
答案
解:(1)B是5号元素,B原子核外电子排布式为1s22s22p1,
故答案为:1s22s22p1;
(2)a.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故a错误;
b.六方相氮化硼层间作用力为范德华力,所以质地软,故b正确;
c.两种晶体中的B-N键均为共价键,故c正确;
d.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,故d错误;
e.立方氮化硼与金刚石类似(如图2),晶胞中小白色球数目为4,大白色球数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即晶胞中含有4个B原子,4个N原子,故e正确,
故选:bce;
(3)六方相氮化硼晶体层内一个硼原子连接3个N原子,B原子价层电子对数为3,所以构成的空间构型为平面三角形;六方相氮化硼晶体的片状结构中没有自由电子,而石墨晶体片状结构中有自由电子,故石墨可以导电、六方相氮化硼不导电,
故答案为:平面三角形;六方相氮化硼晶体的片状结构中没有自由电子;
(4)由晶胞结构可知,立方氮化硼中氮原子周围的4个硼原子形成四面体结构,B原子周围的4个N原子也形成正四面体,即处于晶胞顶点上的原子配位数为4;晶胞中N原子数目=4、B原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量=4×$\frac{14+11}{{N}_{A}}$g,晶体密度=4×$\frac{14+11}{{N}_{A}}$g÷(361.5×10-10 cm)3=$\frac{4×25}{(361.5×1{0}^{-10})^{3}×{N}_{A}}$g/cm3,
故答案为:4; $\frac{4×25}{(361.5×1{0}^{-10})^{3}×{N}_{A}}$;
(5)NH4+中含有1个配位键,BF4-中含有1个配位键,1molNH4BF4含有2mol配位键,
故答案为:2。
故答案为:1s22s22p1;
(2)a.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故a错误;
b.六方相氮化硼层间作用力为范德华力,所以质地软,故b正确;
c.两种晶体中的B-N键均为共价键,故c正确;
d.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,故d错误;
e.立方氮化硼与金刚石类似(如图2),晶胞中小白色球数目为4,大白色球数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即晶胞中含有4个B原子,4个N原子,故e正确,
故选:bce;
(3)六方相氮化硼晶体层内一个硼原子连接3个N原子,B原子价层电子对数为3,所以构成的空间构型为平面三角形;六方相氮化硼晶体的片状结构中没有自由电子,而石墨晶体片状结构中有自由电子,故石墨可以导电、六方相氮化硼不导电,
故答案为:平面三角形;六方相氮化硼晶体的片状结构中没有自由电子;
(4)由晶胞结构可知,立方氮化硼中氮原子周围的4个硼原子形成四面体结构,B原子周围的4个N原子也形成正四面体,即处于晶胞顶点上的原子配位数为4;晶胞中N原子数目=4、B原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量=4×$\frac{14+11}{{N}_{A}}$g,晶体密度=4×$\frac{14+11}{{N}_{A}}$g÷(361.5×10-10 cm)3=$\frac{4×25}{(361.5×1{0}^{-10})^{3}×{N}_{A}}$g/cm3,
故答案为:4; $\frac{4×25}{(361.5×1{0}^{-10})^{3}×{N}_{A}}$;
(5)NH4+中含有1个配位键,BF4-中含有1个配位键,1molNH4BF4含有2mol配位键,
故答案为:2。
解析
步骤 1:确定基态硼原子的电子排布式
B是5号元素,根据原子序数,B原子核外电子排布式为1s^{2}2s^{2}2p^{1}。
步骤 2:分析两种晶体的性质
a.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故a错误;
b.六方相氮化硼层间作用力为范德华力,所以质地软,故b正确;
c.两种晶体中的B-N键均为共价键,故c正确;
d.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,故d错误;
e.立方氮化硼与金刚石类似(如图2),晶胞中小白色球数目为4,大白色球数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即晶胞中含有4个B原子,4个N原子,故e正确。
步骤 3:确定六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型
六方相氮化硼晶体层内一个硼原子连接3个N原子,B原子价层电子对数为3,所以构成的空间构型为平面三角形。
步骤 4:解释六方相氮化硼晶体不导电的原因
六方相氮化硼晶体的片状结构中没有自由电子,而石墨晶体片状结构中有自由电子,故石墨可以导电、六方相氮化硼不导电。
步骤 5:确定立方氮化硼中氮原子周围的配位数
由晶胞结构可知,立方氮化硼中氮原子周围的4个硼原子形成四面体结构,B原子周围的4个N原子也形成正四面体,即处于晶胞顶点上的原子配位数为4。
步骤 6:计算立方氮化硼的密度
晶胞中N原子数目=4、B原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量=4×$\frac{14+11}{{N}_{A}}$g,晶体密度=4×$\frac{14+11}{{N}_{A}}$g÷(361.5×10^{-10} cm)^{3}=$\frac{4×25}{(361.5×1{0}^{-10})^{3}×{N}_{A}}$g/cm^{3}。
步骤 7:确定NH_4BF_4中配位键的数目
NH_4^{+}中含有1个配位键,BF_4^{-}中含有1个配位键,1molNH_4BF_4含有2mol配位键。
B是5号元素,根据原子序数,B原子核外电子排布式为1s^{2}2s^{2}2p^{1}。
步骤 2:分析两种晶体的性质
a.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故a错误;
b.六方相氮化硼层间作用力为范德华力,所以质地软,故b正确;
c.两种晶体中的B-N键均为共价键,故c正确;
d.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,故d错误;
e.立方氮化硼与金刚石类似(如图2),晶胞中小白色球数目为4,大白色球数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即晶胞中含有4个B原子,4个N原子,故e正确。
步骤 3:确定六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型
六方相氮化硼晶体层内一个硼原子连接3个N原子,B原子价层电子对数为3,所以构成的空间构型为平面三角形。
步骤 4:解释六方相氮化硼晶体不导电的原因
六方相氮化硼晶体的片状结构中没有自由电子,而石墨晶体片状结构中有自由电子,故石墨可以导电、六方相氮化硼不导电。
步骤 5:确定立方氮化硼中氮原子周围的配位数
由晶胞结构可知,立方氮化硼中氮原子周围的4个硼原子形成四面体结构,B原子周围的4个N原子也形成正四面体,即处于晶胞顶点上的原子配位数为4。
步骤 6:计算立方氮化硼的密度
晶胞中N原子数目=4、B原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量=4×$\frac{14+11}{{N}_{A}}$g,晶体密度=4×$\frac{14+11}{{N}_{A}}$g÷(361.5×10^{-10} cm)^{3}=$\frac{4×25}{(361.5×1{0}^{-10})^{3}×{N}_{A}}$g/cm^{3}。
步骤 7:确定NH_4BF_4中配位键的数目
NH_4^{+}中含有1个配位键,BF_4^{-}中含有1个配位键,1molNH_4BF_4含有2mol配位键。